
英语原文共 11 页,剩余内容已隐藏,支付完成后下载完整资料
在皮肤镜图像上使用神经网络集成模型的黑色毒瘤的分割
摘要-通过分析数字皮肤镜图像我们开发了一种分类黑素肿瘤良恶性的新方法。该算法按照以下三个步骤:第一步,使用自生成神经网络(SGNN)来提取病变;第二步,提取肿瘤颜色、纹理和边界描述特征;第三步,使用基于神经网络集成模型的分类器分类病变物体。在临床情况下,病变太大而不能完全被包含在皮肤镜图像中。为了处理这个困难的情况,我们提出新的边界特征,其可以在完全和不完全病变图像上有效描述边界不规则性。我们模型设计了一种网络集成分类器,其将BP神经网络和模糊神经网络结合起来实现了更好的表现。试验在两个不同的皮肤镜数据库中进行,这两个数据库包含了黄种人和白种人皮肤数据。结果显示,通过新边界特征的使用和提出的分类模型,分类精度极大提高。
一 介绍
恶性黑色毒瘤(MM)是第三大最频繁的皮肤癌类型和最恶性癌症其中之一[1][2]。单独的侵袭性黑色素瘤估计发病率达73870,2015年估计总共有9940例黑色素瘤在美国发生死亡事件[3]。跟美国、欧洲和澳大利亚相比,皮肤发病在中国的癌症较低,但仍每年以3%-8%增长,且在过去十年中翻了一番[4]。
皮肤镜检查是一种非侵入性皮肤成像技术,其允许放大的皮肤表面和皮下结构的可视化[5]。皮肤镜检查图像已经通过协助MM的早期诊断在提高患者生存率方面发挥重要作用。但是,由人类专家制造的诊断,仍然是清晰的黄金标准,但其是主观的。的确,诊断的准确性和重复性高度依赖于医师的专业知识。据报道当由经验不足的皮肤科医生使用时,皮肤镜确实降低了诊断的精度[6]。不是主观的皮肤癌计算机辅助诊断系统(CAD)能够协助医生在病变边界检测、量化诊断特征、类型分类病变等等方面做出决定[2]。通过Schindewolf et al.[7],当有经验的皮肤科医生使用CAD评估皮肤癌时,MM的诊断精度可以提高75%到高达92%。
通常计算机皮肤镜图像分析模型包括四个方面:预处理、分割、特征提取和分类。跟病变物体分类有关的研究的文献可以早到1987年[8]。皮肤科医生染色皮肤病变评估使用“ABCD”规则[9][10],其分析不对称、边界不规则、颜色变化和不同的病变结构。基于“ABCD”规则,许多分类方法已经在不同的皮肤镜图像数据集上得到发展。在[11], Kusumoputro et al从皮肤镜图像中提取了18中形状和颜色特征并且训练了一个人工神经网络去区分MM和良性病变。在[12],Ganster et al.从病变图像中提取了一系列特征,包括形状、边界梯度和颜色蓝色描述符号。从这些特征中选取最区别性的特征。最后K近邻(KNN)分类器对这些特征进行了训练,达到87%的敏感度和92%的特异性。在[13],437个颜色、纹理和形状描述特征被提取,其中选取了18个最优特征。然后训练支持向量机(SVM)来将病变分类为良性或恶性。Capdehourat et al.[14]通过一系列特征如形状、颜色和纹理信息来描述每个候选病变,其以前使用C4.5决策树来训练了AdaBoost分类器。这个模型在一个自动分割的数据集上达到了77%的特异性和90%的敏感度,而在一个人工分割的数据集上达到了85%的特异性和90%的敏感度。
大多数有关计算机辅助病变分类的已有文献集中在图像的特征提取和分类器设计,且假设该图像包含一个或完全或不完全的病变对象。然而图像不总是能捕获完整的病变,如图1所示。局部特征可以用来处理复杂的情况。Situ et al.[15]使用小波和Gabor-like滤波器从16X16的图像块提取了局部特征,然后使用bag-of-features(BoF)模型识别MM,并分析了其响应。在[16],Barata et al.提取了纹理和颜色特征,然后使用BoF模型去编码这些特征来分类病变。然后他们通过施加颜色恒定约束来改善分类性能[17]。为了更好的处理不完全病变,这些在[16]和[17]里的特征被从图像块中提取。但是边界特征被忽略,而这对病变诊断是很重要的。在这儿我们提出了一种旨在处理不完全肿瘤呈现的皮肤镜肿瘤分类模型。我们将利用一系列肿瘤边界特征和其他的肿瘤描述特征送到一个神经网络超集成模型中来训练去区分恶性和良性病变。
本文其余部分组织如下。部分二描述预处理和分割,部分三展示特征提取,部分四介绍神经网络集成模型,在部分五和六我们展示并讨论了实验结果。最后部分七给出总结。
图1包含不完全病变对象的皮肤镜图像
二 预处理和分割
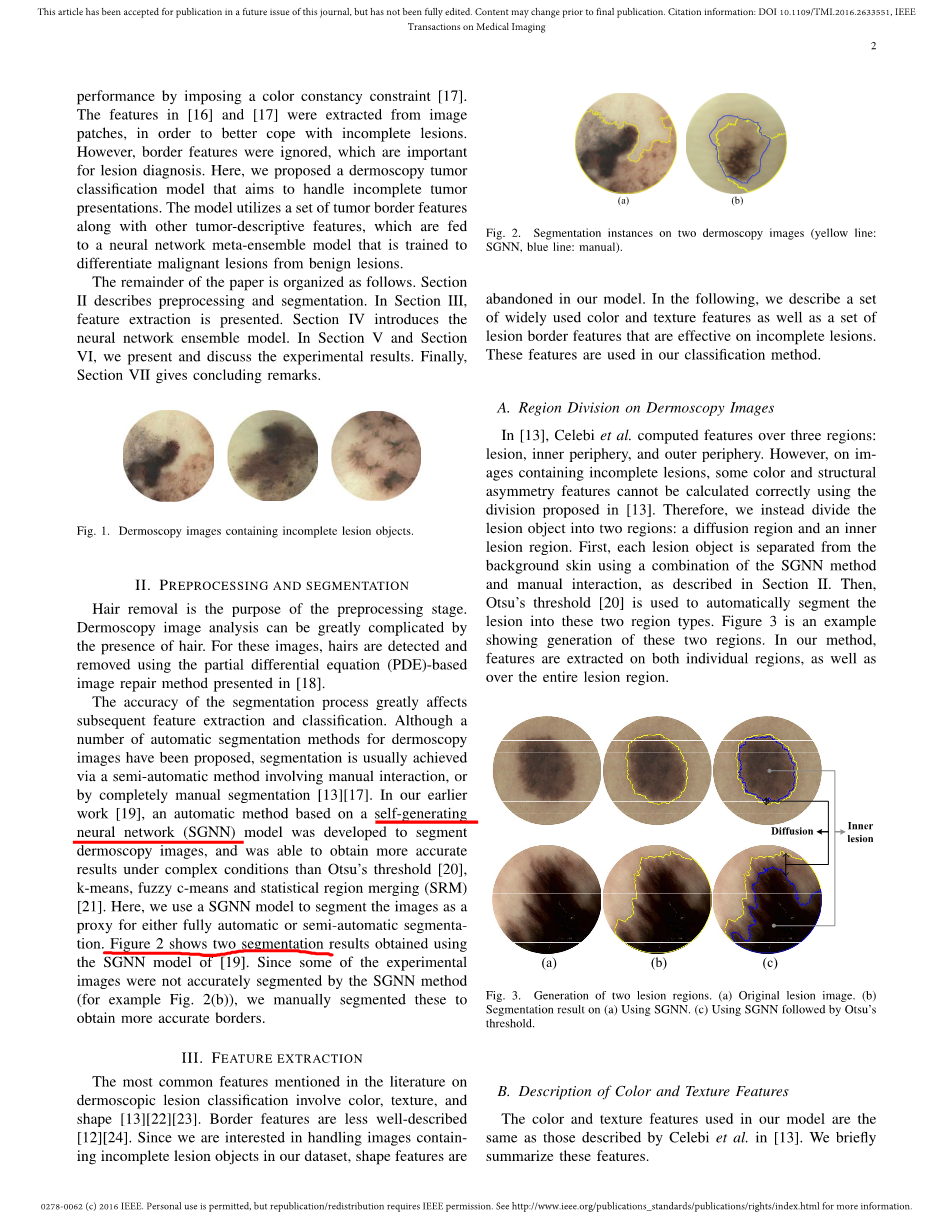
脱毛是预处理阶段的目的。皮肤镜图像分析会因为毛发的存在变得很复杂。对于这些图像,毛发可以通过使用基于部分微分方程(PDE)的图像修复方法来检查和移除[18]。分割处理的精确度会极大影响后续的特征提取和分类。尽管大量的对皮肤镜图像自动分割的方法已经提出,分割通常通过包含手工相互作用的半自动分割方法实现,或者通过不完全的人工分割实现[13][17]。在我们早期工作中[19],一个基于自生成神经网络(SGNN)模型的自动方法被用来分割皮肤镜图像,并且在复杂的情况下比大津阈值(Otsursquo;s threshold )[20]、k-means、模糊 c-means和统计区域合并(SRM)[21]获得更精确的结果。在这儿,我们使用SGNN模型来分割图像作为全自动或半自动分割的代理。图二显示了使用[19]SGNN模型的两种分割结果。因为一些实验图像不能通过SGNN模型来精确分割(见图2(b)),我们手动分割了这些图像来获得更精确的边界。
图2 两张皮肤镜图像的分割实例(黄线:SGNN,蓝色:手动)
三 特征提取
关于皮肤镜病变分类文献中提到的最常见的特征包括颜色、纹理和形状[13][22][23]。边界特征很少描述[12][24]。因为我们对我们数据集中包含不完全病变对象的处理感兴趣,我们模型放弃了形状特征。下面我们描述了一系列广泛使用的颜色和纹理特征,其在不完全病变上是有效的。我们分类模型中使用了这些特征。
A.皮肤镜图像上的区域分割
在[13],Celebi et al.在三个区域上计算特征:病变、内边缘和外边缘。然而,关于包含不完全病变的图像,一些颜色和结构不对称特征不能通过[13]中提到的方法正确计算。因此,我们将病变对象分为两个区域:扩散区域和内部病变区域。首先,通过使用SGNN和人工结合的方法,我们将每个病变对象从皮肤背景分离,正如在部分二描述的那样。然后,Otsursquo;s threshold[20]被用来将这病变自动分割为两个区域类型。图三是一个展示了这两个区域一代的例子。在我们方法中,特征在这两个独立区域和全部病变区域提取。
图三 两个病变区域的一代(a):原始病变图像。(b):在(a)上使用SGNN的分割结果。(c):在(a)先使用Otsursquo;s threshold再用SGNN的分割结果
B 颜色和纹理特征描述
我们模型中使用的颜色和纹理特征跟Celebi et al.在[13]中描述的一样。我们简要的概述一下这些特征。
1)颜色特征
(a)RGB特征:每个皮肤镜图像可以提取总共24种以RGB颜色空间展示的颜色特征。在这些特征中,18种计算如下:对于每个3通道RGB,在三个分割区域(扩散、内病变、全病变对象)计算两个统计值(通道均值和标准差)。剩下的6个特征是相应的来自内部和扩散区域的统计值。用micro;region和sigma;region表示一个区域通道的均值和标准差,这些特征中的三个是在三个通道上的,相似的特征用sigma;region来定义。
(b)LUV直方图距离:LUV颜色空间粗糙量化为4x8x8的小块。内部区域和过渡区域的颜色相似性表达为差异直方图的L1标准和L2标准,产生两个额外颜色特征。
(c)颜色多样性:RGB颜色空间分为16x16x16的小块。然后计算被分开像素的小块数量。小块数量越多,病变为恶性的可能性越大。在这儿可以找到一个特征。
(d)质心距离:给一个分割病变对象,在对象几何中心和亮度中心计算距离。如果对象的染色是均匀的,几何中心和亮度中心应该是相似的。这对于不完全病变对象也适用。通过计算每个RGB通道的距离获得三个特征。
2)纹理特征
空间变化、随机性和图像局部区域亮度是可能为恶性的重要描述。基于灰度共生矩阵(GLCM)的纹理描述是最著名且广泛使用的方法,见文献[25]。在这篇文章中,从GLCM计算了5个统计纹理描述:区域能量、熵、对比度、逆差异时刻和相关性。这5个统计值也在每个三分割区域计算(扩散、内病变和全病变对象)。而且也计算了5个在扩散和内病变区域的统计值比率。每个候选病变图像可以提取20个纹理特征。
C 边界特征描述
边界特征可以用来描绘病变边界不规则度,其一般是基于颜色、纹理和亮度梯度的测量。Ganster et al.[12]计算了区域边界的梯度归一化亮度值。各种样本统计例如最小值、最大值、平均值和方差用来作为边界特征。和[12]中方法类似,[24]中的方法使用一系列梯度特征来描述边界区域,包括候选病变边界和在三个独立通道(颜色、纹理和局部皮肤黑暗)的候选边界周围的8个对称区域的梯度均值和方差。这些特征[12][24]仅仅在完全病变对象上提取。为了从不完全对象中提取边界特征,需要获得能在不完全病变中操作的新边界特征,从而削弱病变分类对完全获取皮肤镜图像的依赖性。
1)病变凹度特征
良性病变往往有粗糙的椭圆形状和圆形凸边界但展示很少的凹度。恶性病变常展示高度不规则边界,而这可以描述为有更多频繁的凹度。例如,凸包(convex hull)是一个识别边界凹度的有用工具。图四展示了良恶性病变的凸包。我们使用病变凸包来定义6种特征参数,这些参数描述在病变边界的凹陷的角度。
图四病变区域和它们的凸包。(a):良性皮肤镜图像(上)和恶性皮肤镜图像(下)。(b):分割的病变区域,红线为叠加的凸包。
图五显示了从图四恶性病变图像中提取的凹度,且描述了量化边界凹度的的方法。让表示沿病变对象边界的独特凹度分割的数量,让、和分别表示第i个凹度的跨度、深度和面积。然后如下在病变对象上定义三双样本统计:
(a)跨度的均值和标准差
(b)深度的均值和标准差
(c)平均厚度的均值和标准差
图5 在图四恶性病变上提取凹陷
关于良性病变,凹度在跨度和深度上往往更小、更浅并且更一致。而恶性病变往往是高度变化的跨度、深度和厚度。因此这6个特征参数的值在恶性病变上比在良性病变上更大。在不完全对象图像上也有相同结果,记住在图像帧的人工边界不包括在计算中。
2)在内部和外部边界的分离
正如在部分三-A中描述的那样,病变检测被分割且内部和扩散病变区域在图三中被识别举例。了新良性病变往往有更好的外部病变边界(图三中的黄色轮廓)和内部病变边界(蓝色轮廓)。在内部和外部边界的扩散区域一般宽度一致,然而恶性病变展示的扩散区域少有规则,其扩散宽度不一致。恶性病变的内部和外部边界的变异比起良性病变高度可变。
让和分别表示外部和内部边界,并且d(,)表示两个像素和的欧几里得距离。然后将从外部边界的第i个像素到内部边界的距离定义为:
内外边界之间的变异程度表示为外边界像素到内边界距离的方差:
其中是外边界的长度(按像素)且
和良性病变的边界描述相比,恶性病变的内外边界往往按不同路径导致内外边界的高度变异。因此恶性病变的往往更大。这个测量也同样可以应用到不完全病变对象上。
D 特征规范化
我们总共描述了57个特征(30个颜色、20个纹理和7个边界)。虽然这些特征是对病变类型的高度描述,但57个特征表现出非常不同的值范围。因此,我们在分类之前通过形成z分数来应用特征规范化,其过程如下:
其中是第i个样本的第j个特征的值,和分别是第j个特征的均值和标准差。使用(10),大多数值被强制到[0,1]范围内,超多这个范围的值被强制为0或1。
E 降低特征维度
一个有效的特征减少处理可以消除冗余、不相关性和噪音特征且同时可以提高分类性能。例如,在[13]中,Celebi et al.提取了437个原始特征,然后使用基于特征选择的相关性方法(CFS)从中选取了18个最优特征来增加病变分类精度。然而这个方法不能完全移除冗余。主成分分析(PCA)是一个降维的受欢迎的方法。给一系列n维数据,PCA旨在找到一个低于n维的d维线性子空间以致于数据点主要位于这个线性子空间上[26]。在这儿,通过PCA滤除冗余、不相关性和噪音特征来减少特征。详细的描述见部分五。
四 基于神经网络集成的分类器设计
人工神经网络[11]、SVM[13]、Ada
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[27880],资料为PDF文档或Word文档,PDF文档可免费转换为Word


