
英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
免疫亲和纯化技术在中药预处理的应用
关键词:免疫亲和层析;橙皮苷;柚皮芸香苷;陈皮;中药;净化技术
摘要
在本研究中,评价了免疫亲和层析(IAC)作为用于分析中医药(TCM)中的生物活性成分的纯化技术的可行性。IAC用于分析含有陈皮(CRP、在中国称Chenpi)的中药制剂中的橙皮苷(HP)、柚皮芸香苷(NR)。开发并表征了用于从含有CRP的TCM制剂中特异性提取和富集HP和NR的IAC柱。在HP与羰基二咪唑反应并与蛋白质偶联后,将其用于免疫小鼠以产生抗体。通过细胞融合,克隆和筛选,获得单克隆抗体。通过将针对HP和NR的特异性单克隆抗体共价偶联到CNBr活化的Sepharose 4B上并包装到普通固相萃取柱中来构建IAC柱。 优化了包括加载,洗涤和洗脱的提取条件,以及用于提取HP和NR的流速。在最佳条件下,还对IAC柱的最大容量,萃取回收率和稳定性进行了表征。结果显示,IAC柱对HP和NR的最大容量为约16mu;g,每1mL柱体积的相对结合容量为27mu;g。在三个添加水平的HP和NR的IAC柱的萃取回收率在94.05-109.15%的范围内。重复施用5次后,未观察到特异性识别的显着损失。使用高效液相色谱(HPLC)作为有效的分析工具,可以通过IAC柱成功分离HP和NR,而没有来自杂质的推断,表明使用制备的IAC柱提取HP和NR是可行的。 IAC的应用可以解决由于严重干扰或低含量的定量分析的问题。此外,不同基质中的预处理方法可以统一。 IAC纯化方法可用作TCM中生物活性组分的预处理的备选有效分析方法。
绪论
由于中药制剂的复杂组分和低含量的生物活性成分,成功的分析取决于样品纯化技术的预处理。随着科学技术的发展,现代仪器分析的检测技术和效率大大提高。然而,中药制剂的预处理方法仍然是传统的,这导致样品预处理和检测技术之间的差距越来越大。
传统的纯化方法如液 - 液萃取和柱色谱具有多种缺点,包括需要大量的有机溶剂,耗时和低选择性。此外,需要根据不同的基质建立不同的方法,导致更难以统一不同TCM制剂的检测技术。基于抗原和抗体之间的高度特异性相互作用的免疫亲和层析(IAC)是用于样品的预处理的极好的方法。它具有抗体和抗原之间的特异性和可逆相互作用的优点,并且被认为是用于从复杂基质中单步纯化和冷凝目标分析物的最强大的技术之一[1]和[2]。此外,由于在IAC中使用相对少量的有机溶剂,IAC方法具有高效纯化,操作简单和环境友好的特点。由于IAC不同基质中的高特异性,强富集能力和纯化效率,它已经在许多方面得到广泛应用。已经报道了IAC用于预处理含有毒素,生物大分子和药物残留的各种样品的应用[3],[4],[5],[6]和[7]。理论上,只要满足某种结构要求的材料可以用作半抗原来制备相应的抗体,它可以用于IAC柱用于纯化生物活性成分。由于IAC的优点,它可以解决在严重干扰或低含量或复杂预处理的情况下的定量分析的问题。此外,不同基质中的预处理方法可以统一。因此大大简化了预处理步骤,提高了分析方法的灵敏度。
在本研究中,IAC用于分析含有Citri reticulatae Pericarpium(CRP,Chenpi)的TCM制剂中的橙皮苷(HP)和narirutin(NR)。探讨了IAC技术在中药制剂中生物活性成分含量测定的可行性。
中国传统草药,CRP,是成熟的柑橘网(Blanco)柑橘果实的干果。它在中国药典正式上市,并已广泛用于治疗消化不良和一些炎症综合征如支气管炎和哮喘[8]和[9]。此外,其治疗功能包括降低温度,舒缓性哮喘,刺激食欲和增强免疫系统功能也已被报道[8和10]。植物化学和药理学研究已经证明CRP中的主要成分是类黄酮。据报道,这些柑橘类黄酮具有多种生物活性,包括抗惊厥[11],抗癌[12]抗诱变[13],抗炎[14]和[15]和抗氧化性质[16]和[17]。
在这些化合物中,HP和NR具有特殊的生物活性[18]。 HP可以通过减少异常渗漏来改善毛细血管功能,从而可以用于减少下肢的毛细血管损伤和静脉功能不全[19]。 NR可以减轻乙醇诱导的肝损伤,这与其抗炎和抗氧化活性有关[20]。 HP和NR是CRP中含量较高的类黄酮[21]。
CRP作为常用的中草药,已被广泛应用。在“中国药典”2010年版[8]中已经记录了含有CRP的130个TCM制剂,但是由于其组成复杂和测定中其他化合物的严重干扰,CRP的质量控制方法尚未确立。
在本研究中,在HPLC分析之前,已经表征了基于单克隆抗体(mAb)的免疫亲和层析作为HP和NR在含有CRP的TCM制剂中的纯化程序的产生和应用。
本研究的目的是:(1)制备用抗HP和NR mAb及CNBr活化琼脂糖树脂包装的IAC柱; (2)优化从IAC柱结合和释放抗体结合的HP和NR的提取条件; (3)评价制备的IAC柱从TCM制剂中提取HP和NR的效率; (4)评估使用IAC作为用于分析中药制剂中生物活性成分的纯化技术的可行性。
- 实验
2.1. 试剂和材料
HP购自国家药物和生物制品控制研究所(中国北京)。 NR购自ChromaDex(California,USA)。 HPLC级甲醇购自Fisher Scientific,Inc。(Pittsburgh,USA)。通过Milli-Q系统(Millipore,Milford,MA,USA)通过蒸馏水制备去离子水(18.2MOmega;)。所有其他化学品和溶剂均为分析纯,并从北京化学试剂有限公司(中国北京)订购。
用于制备IAC的所有试剂如二甲基亚砜(DMSO),羰基二咪唑(CDI),牛血清白蛋白(BSA),鸡卵清蛋白(OVA),Tris,弗氏佐剂,弗氏不完全佐剂和石蜡油购自Sigma-Aldrich(St.Louis,USA)。磷酸二氢钾,磷酸二氢钠,氯化钠,氯化钾,硫柳汞和NaHCO 3购自Merck(Darmstadt,Germany)。 HCl购自J.T. Baker(美国)。 Pierce丁酰乳酸丙烯酸酯(BCA)蛋白测定试剂盒购自pierce(USA),CNBr活化的Sepharose 4B购自GE(USA)。 Balb / c小鼠(6-8周龄,雌性)购自SPF Laboratory Animal Technology Co.,Ltd。(北京,中国)
2.2. 抗原和单克隆抗体的制备
将约6.2mg HP溶解于300mu;LDMSO中,然后将20mg CDI加入DMSO溶液中。将混合物置于37℃水浴中反应1小时,得到溶液A.将约10mg BSA溶解在2mL的0.01M PBS溶液(pH7.3)中以获得溶液B.在冰水条件下连续搅拌下将溶液A逐滴加入溶液B.将混合物溶液置于2-8℃过夜。然后,将混合物在0.01M PBS溶液(pH 7.3)中透析2天,每天更换缓冲液3次。最后,获得HP-BSA缀合物作为抗体产生的免疫抗原。用10mg OVA代替BSA用于合成作为检测抗原的HP-OVA。
用于在小鼠中产生免疫应答和产生单克隆抗体的程序根据常规方法进行[22]。通过蛋白G纯化,获得用于HP的单克隆抗体,并使用SDS-PAGE来评价纯化效率。
2.3. 制备IAC柱
将纯化的HP单克隆抗体与CNBr活化的Sepharose 4B偶联,以根据制造商的说明书进行少量修改来制备HP的IAC。
2.4. IAC柱的最大结合容量的测定
根据以前的报告[23]确定制备的IAC柱的最大结合容量。 在最佳提取条件下,将分别以3mL部分分别连续加载溶解在50mL 1%甲醇中的总共30mu;gHP或30mu;gNR。 收集负载级分并在70℃下在氮气吹扫下蒸发至0.7mL,然后使用甲醇稀释至1mL。 收集洗脱级分。 通过HPLC测定洗脱级分和负载级分中HP和NR的含量,用于计算IAC柱的结合容量。 当在相同的IAC柱中加载HP和NR时,也确定IAC柱的最大结合容量。
2.5. 样品制备
通过将8.00mg的每种标准品溶解在50mL的MeOH中制备HP和NR(150mu;g/ mL)的个体储备标准溶液。然后,将HP和NR的标准溶液分别在水中稀释100和625倍,以备将来使用。
为了评价IAC柱的纯化效率,收集含有CRP的TCM制剂。将测试样品研磨成粉末。根据处方中CRP的比例计算取样量。共同取样量相当于40mg CRP。准确称量样品粉末,并在25mL甲醇中超声提取30分钟。萃取后,将后续滤液稀释500倍,然后装入IAC柱。总共25mL的稀释的提取溶液通过IAC柱(用10mL PBS预先调节)以3mL / min的流速进行纯化。将柱用水(10mL)洗涤并用甲醇(2mL)洗脱。所得洗脱液用水稀释至2mL,最后用HPLC测定。
2.6. HPLC条件
使用以1.0mL / min的流速使用乙腈(流动相A)和水(流动相B)的梯度HPLC系统,在Agilent SB-C18柱(C18,4.6mmtimes;250mm,5 mu;m粒径)。 根据以下程序在洗脱液A下进行分析,初始比例为10%,在5.0分钟内线性增加至15%,在15.0分钟内线性增加至35%,然后在20.0分钟内线性增加至90%,最后 在0.5分钟内回到10%洗脱液A并保持平衡9.5分钟。 总运行时间为30分钟。 检测器的波长设定为283nm。 注射体积为10mu;L。
- 结果与讨论
3.1. 单克隆抗体的生产和表征
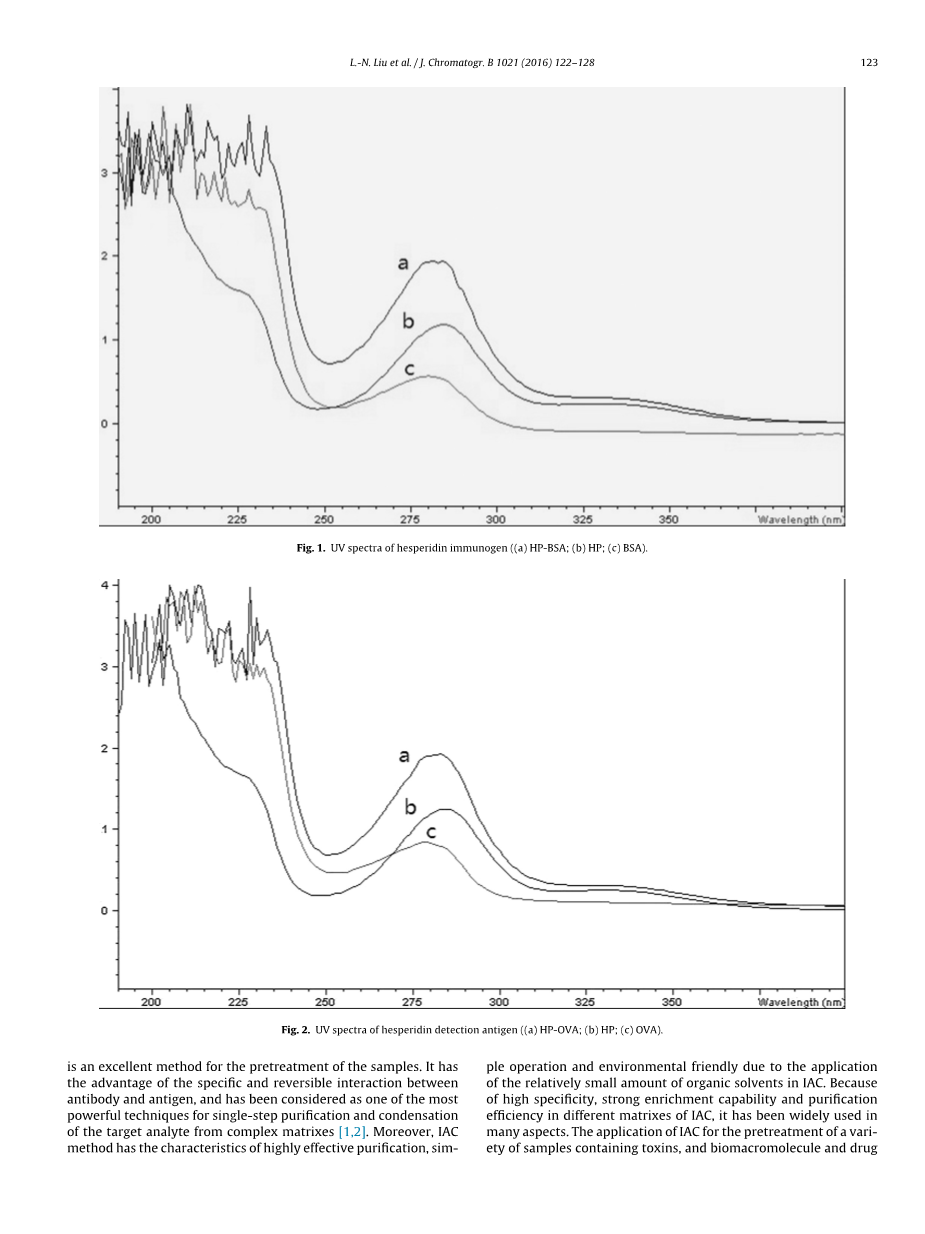
橙皮苷作为小分子有机化合物,必须与大分子蛋白偶联以完成其免疫原性[24]。橙皮苷中的羟基可以与羰基二咪唑反应,从而实现大分子蛋白与橙皮苷的羟基的偶联,制备橙皮苷-BSA免疫原和橙皮苷-OVA检测抗原。通过紫外分光光度计对橙皮苷BSA和橙皮苷-OVA进行光谱扫描,并与载体蛋白和HP的光谱进行光谱比较。结合抗原的吸收峰信号是橙皮苷和偶联蛋白的吸收峰的叠加,这证实了橙皮苷成功偶联到载体蛋白上
使用合成的橙皮苷-BSA免疫的Balb / c小鼠产生杂交瘤细胞系并制备腹水。经蛋白G柱纯化后,得到橙皮苷单克隆抗体,纯化效率。抗体的重链和轻链的分子量分别确定为50kDa和25kDa。
筛选后,选择对HP和NR具有交叉反应性并且对HP和NR同源物(例如橙皮素,新橙皮苷和柚皮苷)几乎没有交叉反应性的抗体。如表1所示,该抗体显示对HP和NR的高特异性,并且对橙皮素,新橙皮苷和柚皮苷几乎没有交叉反应性。
3.2. IAC柱的性能评价
使用BCA试剂盒测定上清液的偶联速率,以评价抗体和填充偶联试剂之间的偶联效率。 结果表明,所有耦合率均大于97%。
3.3. IAC色谱柱的萃取条件优化
IAC柱的负载条件,流速和洗脱条件的评价是必要的,因为这些条件可能对抗原 - 抗体结合和抗体活性的结合和解离以及分析物的回收率具有强烈影响。
在本研究中,为了获得最佳的提取条件,不同的加载溶液(1%,5%,10%,20%和30%甲醇)流速为1.0,3.0和6.0 mL / (乙腈和甲醇)和洗脱体积(1,2,3,4和5mL)。此外,还检测了样品的pH和装载体积。
观察到加载溶液的pH和流速对IAC柱对HP的结合速率没有显着影响。结果表明,甲醇比例在1-20%范围内,回收率逐渐降低,回收率仍然保持在90%以上。然而,如果甲醇比进一步增加,回收率显示急剧下降。因此,需要不超过20%的甲醇水溶液作为装载介质。加载溶液体积从5mL增加到50mL可以导致回收率从81.04%增加到100.6%。进一步增加装载溶液显示对回收率没有明显影响。考虑到时间消耗,20mL加载溶液是最佳加载体积。 HP可以通过2mL甲醇完全洗脱。在洗脱溶液中增加的甲醇体积对回收率没有影响。然而,乙腈不能完全洗脱HP。在这种情况下,选择甲醇作为洗脱溶液,并且结合在柱上的HP可以通过2mL的该溶液释放。
3.4. IAC柱提取回收率
在最佳提取条件下,通过在三种不同的加标浓度下加载NR和HP标准溶液来测量IAC的回收率。 将每个浓度的NR或HP(对于HP分别为5.4,2和0.54mu;g,分别为6.0,2.4和0.60mu;g)的总体积50mL装载到柱上。表2总结了来自IAC柱的HP和NR回收率。 所有色谱柱的HP和NR回收率范围为94.05至109.15%,这些色谱柱的相对标准偏差(RSD)小于6.2%。 因此,当用12,40和120ng / mL的HP和NR溶液在2%甲醇中攻击时,制备的IAC柱可结合相似量的HP和NR并且执行相似的功能。 结果表明,由HP优化的条件也可以应用于NR。
3.5. IAC柱的最大结合容量的测定
IAC柱对HP和NR的最大结合容量测定为16mu;g,每1mL柱体积的相对结合容量分别为27mu;g。 然而,当在相同IAC柱中加载HP和NR时,HP和NR之和的最大结合容量也被确定为16mu;g,并且HP的结合容量为11.12mu;g,NR的结合容量为5.18mu;g,这表明 HP和NR是竞争性吸附,HP的特异性高于NR。 这一结果与交叉反应的结果一致,与CRP中HP和NR的含量关系一致[21]。
3.6. IAC柱的稳定性
针对小分子化合物的抗体通常难以产生并且非常昂贵。因此,IAC列预计将被重用。事实上,大多数抗体在一定程度上显示对有机溶剂的耐受性,没有明显的活性损失,使得IAC柱可以容易地用PBS溶液再生。使用后,IAC柱可以用10 mL PBS进行修复,然后柱准备好随后的样品加载。在15mu;gHP存在下测试IAC柱的稳定性。重复施加5次的柱未显示最大结合容量的明显降低,表明IAC柱具有高稳定性。关于各种IAC柱的可重用性的类似结果也已经在先
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[140105],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 治疗骨髓炎的抗菌温敏水凝胶的研究文献综述
- DOX@HMCuS-HA的制备与表征文献综述
- [Me4N][SeCF3]对富电子芳烃的直接三氟甲硒基化反应文献综述
- 三组分顺序偶联法无金属化合成邻甲酰基二芳醚外文翻译资料
- 通过固相萃取从可循环离子液体预萃取剂中回收分析物:一种高效和可持续分析样品制备的通用工具外文翻译资料
- 酰胺类化合物的化学选择性分子间交叉烯醇型偶联外文翻译资料
- NHC-催化吡唑酮与α,β-不饱和醛反应合成功能化吡唑化合物的对映选择性研究,外文翻译资料
- 羧酸作为无痕活化组的共轭体添加:普卡巴林的三步合成外文翻译资料
- 钯催化的有机硼酸和硼酸酯的三氟乙基化反应外文翻译资料
- 铜催化CF3CH2OH与芳基硼酸和异芳基硼酸偶联制备三氟乙基芳基醚外文翻译资料


