双联基萘手性荧光探针对多种游离氨基酸具有超强手性识别能力
Yuan-Yuan Zhu,Xue-Dan Wu,Shuang-Xi Gu and Lin Pu
摘要:设计并合成了一种基于双联萘基结构的新型荧光探针。该化合物与Zn(II)结合时,对13种常见的游离氨基酸显示出高度的对映选择性并且能使荧光增强。例如,其对映体荧光增强比(ef或△Il/△ID)在缬氨酸177,蛋氨酸199,苯丙氨酸186,亮氨酸118,丙氨酸89的存在下是非常高的:。所观察到的高对映体选择性和底物作用范围之广在荧光识别游离氨基酸方面是前所未有的。该荧光探针可用于测定不同结构的手性氨基酸的对映体组成。核磁共振和质谱的研究为阐明所观察的高对映体选择性提供了线索。
介绍:近二十年来,手性有机化合物的荧光对映选择性分子探针的研究取得了很大进展 [1-3]。这些探针在不对称反应的高速分析以及生物系统中的手性分子监测方面具有潜在的应用前景。手性氨基酸是生命的重要组成部分,其自由形式的对映体也显示出重要的生物学功能[4-6] 。此外,天然产生的氨基酸还可以作为多种功能性有机化合物的合成前体,以及不对称合成和催化的手性来源[7.8]。氨基酸的荧光对映体识别是近年来研究的热点[9.10]。 然而,目前许多荧光探针在其对游离氨基酸的荧光反应中只表现出有限的对映体选择性。
先前,我们报导了以1,1-联-2-萘酚(联萘酚)为基础的化合物(S)-1在存在Zn(II)的情况下作为识别功能胺(包括游离氨基酸)的对映选择性荧光探针。11当它被用来和苯丙氨酸反应时,对映体选择性ef(ef=对映体荧光增强比=[ILminus;I0]/[IDminus;I0] =Delta;IL/Delta;ID。I0,探针的荧光强度。ILorID, L或D底物的荧光强度。)到达了13,但对其他氨基酸的对映体选择性低得多。(ef=1minus;4)。为了进一步提高(S)-1在手性氨基酸荧光识别中的对映选择性,我们提出用吡啶单元连接两个二恶唑来设计一种新型的氨基酸传感器,并发现了一种对多种游离氨基酸的高对映选择性荧光探针。本文对这些结果进行了报道。
结果与讨论
- 双联萘酚吡啶分子探针的设计与合成
化合物(S,S)-2被设计用于识别存在Zn(II)的氨基酸。(S,S)-2的两个醛基可以与氨基酸的胺基反应,中心的吡啶单元可以增加与Zn(II)离子的结合。手性氨基酸对对映体处理时,两个手性联萘酚单元有可能相互配合以增强手性偏倚。例如,当(S,S)-2与氨基酸和Zn2 反应时,探针的两个醛基与底物的胺基缩合,再配位Zn(II),可生成类似A的络合物。联萘酚单元和氨基酸单元之间的手性匹配和不匹配可能导致不同的荧光效应,从而得到所需的对映体选择性。
我们开发了一种新设计的双联萘酚化合物的快速合成方法,如Scheme 1所示。在50℃碱性条件下,(S)-3与2,6-二溴甲基-吡啶反应,产率为73%。用盐酸除去S,S)-4的保护基团MOM,可以以91%的产率生成所需的产物(S,S)-2。
(S,S)-2在氘代氯仿的氢核磁波谱中,发现其羟基信号在delta;10.47(2H)处为单谱线。这与(S)-1中的羟基基团相似,表明在这些化合物中类似的分子内氢键。(S,S)-2的核磁共振氢谱也表明,它在溶液中保持了C2的对称性。这种化合物在乙腈溶液中是无荧光的。
- 对L-和D-缬氨酸的荧光反应
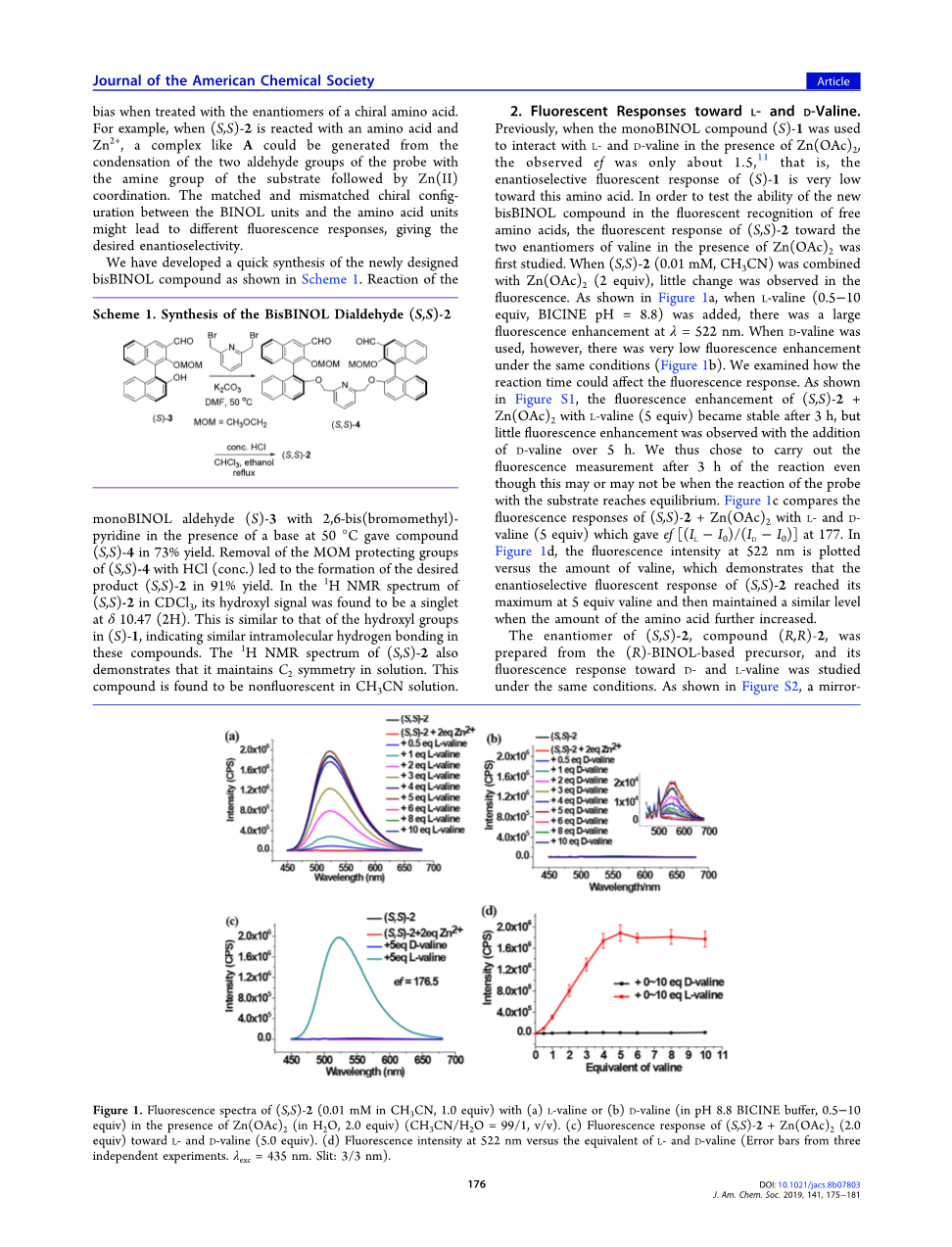
之前,当化合物(S)-1在Zn(OAc)2存在下与L-和D-缬氨酸相互作用时,观察到的ef仅为1.5左右[11],也就是说,(S)-1对该氨基酸的对映选择性荧光反应非常低。为了测试新化合物对游离氨基酸的荧光识别能力,首先研究了在Zn(OAc)2存在下(S,S)-2对缬氨酸的两个对映体的荧光响应。当(S,S)-2(0.01mM,乙腈)与Zn(OAc)2(2当量)结合时,荧光变化不大。如图1a所示,当L-缬氨酸(0.5minus;10当量, 二甘氨酸 pH =8.8)加入时,在lambda;=522nm处有较大的荧光增强。但当使用D-缬氨酸时,在相同条件下荧光增强非常低(图1b)。我们研究了反应时间对荧光响应的影响。如图S1所示,L-缬氨酸(5当量对(S,S)-2 Zn(OAc)2的荧光增强作用在3h后趋于稳定,但D-缬氨酸的加入时间超过5h后,荧光增强效果不明显。因此我们选择在反应3h后进行荧光测量,尽管不知道在探针与底物的反应是否达到平衡。图1c比较了(S,S)-2 Zn(OAc)2与L-和D-缬氨酸(5当量)在177时的荧光反应,得出ef[(ILminus;I0)/(IDminus;I0)]。在图1d中,将522 nm处的荧光强度与缬氨酸用量进行对比,表明(S,S)-2的对映选择性荧光响应在5当量缬氨酸时达到最大,随着氨基酸用量的进一步增加,其对映选择性荧光响应保持在相同的水平。以(R)-联萘酚为前体制备(S,S)-2的对映异构体(R,R)-2,并在相同条件下研究了其对D-和L-缬氨酸的荧光响应。如图S2所示,(R,R)-2和(S,S)-2对缬氨酸对映体的荧光响应呈镜像关系,证实了固有的手性识别过程。
图1 (a)L-缬氨酸或(b)D-缬氨酸(pH8.8双碱缓冲液,0.5-10当量)在Zn(OAc)2(水,2.0当量) (乙腈/水=99/1,v/v)存在时的荧光光谱为(S,S)-2(乙腈,0.01 mM, 1.0当量)。(c)(S,S)-2 Zn(OAc)2(2.0当量)对L-和D-缬氨酸(5.0当量)的荧光响应。(d)522nm处的荧光强度与等效的L-和D-缬氨酸相比(三个独立实验的误差线。Lambda;exc=435 nm.Slit: 3/3nm)
上述荧光测量结果表明,双联萘酚基探针(S,S)-2在氨基酸的荧光识别中比化合物(S)-1具有更强的对映选择性。由此确认提出了双联萘酚基-吡啶策略。
在图1的荧光测量中,氨基酸缬氨酸在pH=8.8的双碱缓冲溶液中处于去质子化状态,然后用传感器处理。我们研究了改变氨基酸的初始ph对(S,S)-2 Zn(OAc)2荧光响应的影响。如图2所示,在pH =7.5时,两者都发出荧光。但在酸性条件下(pH=6)或碱性条件下(pH=8.8),L-缬氨酸都能显著增强荧光,且对映体选择性高。这与探针与手性匹配底物的反应是一致的,无论是酸或碱催化的胺-醛缩合形成亚胺。我们研究了(S,S)-和(R,R)-2在不同对映体组成下与缬氨酸的相互作用,并在图3中绘制了每个对映体探针对缬氨酸过量[ee=([L]minus;[D])/([L] [D])]的荧光响应。观察了该对映体探针对的荧光响应之间的镜像关系。这些图谱可用于测定氨基酸的对映体组成。
图2 L-或D-缬氨酸(5.0当量,不同pH缓冲液中)对Zn(OAc)2(0.01 mM 乙腈,1.0当量)在522 nm处的荧光强度与pH的关系(pH 6.0 缓冲液: 0.1 MAcOHminus;AcONa. pH7.5和8.2 缓冲液:25mM 羟乙基哌嗪乙硫磺酸 pH 8.8 缓冲液: 25 mM 缓冲液. 乙腈/水= 99/1, v/v.lambda; exc = 435 nm. Slit: 3/3 nm)
3.对额外氨基酸的荧光反应。
研究了(S,S)-2与Zn(OAc)2结合后对18种常见氨基酸(包括缬氨酸)的荧光响应。在相同的条件下,观察对以下13个氨基酸的对映选择性荧光增强:缬氨酸、蛋氨酸、苯丙氨酸、亮氨酸、丙氨酸、色氨酸、谷氨酰胺、酪氨酸、天冬酰胺、苏氨酸、丝氨酸、组氨酸和精氨酸。一般来说,虽然这些氨基酸的D-对映体不能显著提高探针的荧光强度,但L-对映体在500nm以上时可以显著提高荧光强度(图S3)。5种氨基酸存在时,ef值(S,S)-2极高,缬氨酸为177,蛋氨酸为199,苯丙氨酸为186,亮氨酸为118,丙氨酸为89。图4给出了(S,S)-2 Zn(OAc)2对蛋氨酸、苯丙氨酸、亮氨酸和丙氨酸对映体的荧光响应,这些对映体表现出基本的开/关对映选择性,也就是说,一个对映体打开探针的荧光,另一个对映体保持其关闭状态。(S,S)-2对以下6种氨基酸也显示了较高的ef值:色氨酸(38)、谷氨酰胺(29)、酪氨酸(25)、天冬酰胺(18)、苏氨酸(10)和丝氨酸(8)(图S4)。观察到组氨酸和精氨酸的中度对映体选择性(图S4)。脯氨酸、天冬氨酸、谷氨酸、半胱氨酸和赖氨酸的荧光响应很少(图S3)。所观察到的极高的对映体选择性和(S,S)-2 Zn(OAc)2用于荧光识别游离氨基酸的底物范围都是前所未有的。
图3 (S,S)-2和(R,R)-2(乙腈 0.01 mM, 1 当量)在522nm处的荧光强度与在Zn(OAc)2(水,2.0当量)存在时L-缬氨酸(在pH 8.8 二甘氨酸缓冲液中,5当量)的ee值相比(三次独立实验的误差线 lambda; exc = 435nm. Slit: 3/3 nm)。
图4 (S,S)-2(在乙腈中0.01 mM, 1.0当量)对(a)蛋氨酸,(b)苯丙氨酸,(c)亮氨酸,(d)丙氨酸(在pH 8.8二甘氨酸缓冲液中,5当量)在Zn(OAc) 2存在的荧光响应(水, 2.0当量) (乙腈/水=99/1, v/v.lambda; exc = 435nm).
4.核磁共振和质谱分析研究(S,S)-2 Zn(OAc)2与缬氨酸的相互作用。
我们对(S,S)-2 Zn(OAc)2与L-和D-缬氨酸的反应进行了氢核磁波谱研究。(S,S)-2溶解于乙腈(250微升,02mM)中。25mm、pH8.8的Zn(OAc)2溶液和二甘氨酸缓冲液(25mM,pH8.8)由D2O作为溶剂制备。如图5a所示,(S,S)-2给出了2个单谱线,一个在delta;10.17给出了醛质子的单谱线,一个在delta;8.49给出了萘基质子正对醛的单谱线。添加Zn(OAc)2后,无明显变化。然后,L -缬氨酸的加入导致了一个新的醛信号出现在了约delta;10.15。此外,在delta;8.60和delta;8.47处观察到两个新的信号,这两个信号可以被指定为一个亚胺质子,萘基质子邻位为(S,S)-2的醛基与缬氨酸的胺基缩合形成的新亚胺基。如图5a所示,在Zn(OAc)2存在下(S,S)-2与L-缬氨酸反应平衡时,未反应的(S,S)-2占主导地位。图5b为(S,S)-2 Zn(OAc)2与D-缬氨酸反应的氢核磁波谱谱图。只有一个新的信号在delta;8.60被观察到,这可以分配到一个亚胺质子产生的胺-醛反应。醛质子和邻位芳香质子信号的位移都不明显。本实验中,经过2d反应后(S,S)-2也占优势。在前面的信号区,两组实验中分别从L-和D-缬氨酸的两个非对映体甲基中观察到在(S,S)-2与L-和D-缬氨酸反应生成新的化合物[图S5(a)和5(b)]。
图5 在有Zn(OAc)2(50mu;L,4 mM氘水,2.0当量)存在的不同时间下,(S,S)-2 (500 mu;L,0.2 mM 乙腈, 1.0当量)与L-和D -缬氨酸 (50mu;L, 16 mM 二甘氨酸缓冲液, 8.0当量)的反应混合物的氢核磁波谱。对于两个图,1,(S,S)-2 缓冲液;2,(S,S)-2 缓冲液 2当量Zn(II);3minus;7, L-或D-缬氨酸对应的时间分别为1h,3h,5h,8h,和2d。为了清晰,去除在delta;0-8处的(S,S)-2、缬氨酸和二甘氨酸以及在delta;8.9-9.8处的空白区域的其他信号。图S5给出了完整的光谱)。
上述研究表明,在CD3CN中Zn(OAc)2的存在下,虽然(S,S)-2只有一小部分与L-缬氨酸反应,但生成的产物产生了明显增强的荧光。与之形成鲜明对比的是,D-缬氨酸与(S,S)-2 Zn(OAc)2的反应程度与L-缬氨酸相似,但产物的荧光很少,表明结构非常不同。我们得到了上述(S,S)-2 Zn(OAc)2与L-和D-缬氨酸的反应混合物的质谱(MALDI-TOF),但在这两种情况下都只
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[271160],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 治疗骨髓炎的抗菌温敏水凝胶的研究文献综述
- DOX@HMCuS-HA的制备与表征文献综述
- [Me4N][SeCF3]对富电子芳烃的直接三氟甲硒基化反应文献综述
- 三组分顺序偶联法无金属化合成邻甲酰基二芳醚外文翻译资料
- 通过固相萃取从可循环离子液体预萃取剂中回收分析物:一种高效和可持续分析样品制备的通用工具外文翻译资料
- 酰胺类化合物的化学选择性分子间交叉烯醇型偶联外文翻译资料
- NHC-催化吡唑酮与α,β-不饱和醛反应合成功能化吡唑化合物的对映选择性研究,外文翻译资料
- 羧酸作为无痕活化组的共轭体添加:普卡巴林的三步合成外文翻译资料
- 钯催化的有机硼酸和硼酸酯的三氟乙基化反应外文翻译资料
- 铜催化CF3CH2OH与芳基硼酸和异芳基硼酸偶联制备三氟乙基芳基醚外文翻译资料


