ROS和低氧信号调节昆虫休眠期的代谢兴奋以协调葡萄糖、氨基酸和脂质代谢
原文作者:Chao Chena,1, Rohit Maharb, Matthew E. Merrittb, David L. Denlingerc,d,1, and Daniel A. Hahna,e,1
单位:aDepartment of Entomology and Nematology, The University of Florida, Gainesville, FL 32611-0620; bDepartment of Biochemistry and Molecular Biology, The University of Florida, Gainesville, FL 32610-0245; cDepartment of Entomology, 300 Aronoff Laboratory, The Ohio State University, Columbus, OH 43210; dDepartment of Evolution, Ecology, and Organismal Biology, The Ohio State University, 300 Aronoff Laboratory, Columbus, OH 43210; and eGenetics Institute, The University of Florida, Gainesville, FL 32610-3610
研究意义:从细菌孢子、植物种子、无脊椎动物包囊到滞育昆虫和哺乳动物冬眠,有机体在休眠期间会显著抑制新陈代谢以节省能量。了解控制代谢抑制的调节机制,有助于深入了解休眠期间能量使用的基本控制,并为人工诱导和打破休眠提供了视角。在冬眠期间,一些昆虫和哺乳动物会因为代谢抑制而周期性觉醒。我们发现,昆虫在冬眠和周期性觉醒过程中遵循着与哺乳动物相似的代谢策略,其特征是抑制时的无氧代谢和觉醒时的有氧代谢,强调了代谢调节的基本相似性。ROS的生理水平调节代谢抑制到周期性唤醒的转换,从而控制底物流入三羧酸循环。
摘要:代谢抑制是动物休眠的标志可以促进整体能源节约。一些滞育昆虫和哺乳类冬眠动物有规律的周期性代谢抑制与代谢率急剧增加的周期性觉醒交替。之前主要是在冬眠的哺乳动物身上的研究表明,周期性觉醒是由有氧线粒体代谢的增加所驱动的,许多与能量代谢有关的分子在周期性觉醒周期中是可以预测的。然而,目前还不清楚这些快速的代谢变化是如何调节的。我们首次发现滞育的肉蝇蛹在代谢抑制时主要通过厌氧糖酵解,而在周期性觉醒时通过三羧酸循环进行有氧呼吸。滞育蛹也会清除厌氧副产物,并再生许多在觉醒时代谢抑制中消耗的代谢中间体,这与哺乳动物冬眠的模式一致。我们发现活性氧(ROS)水平的降低会引起代谢兴奋,而活性氧水平的升高会延长代谢抑制的持续时间。我们的数据表明,ROS通过调节低氧诱导转录因子(HIF)和腺苷5-单磷酸活化蛋白激酶(AMPK)的磷酸化水平,改变丙酮酸脱氢酶和肉碱棕榈酰转移酶I两种关键代谢酶的活性来调节代谢觉醒的时间。我们的研究表明,ROS信号在昆虫滞育系统中调节周期性觉醒,这表明ROS在昆虫休眠时调节其他类型的代谢周期可能也很重要。
关键词:ROS; 低氧信号; 周期性兴奋;滞育;冬眠
许多生物体都进化出了休眠策略,使它们的生命周期与生长和繁殖的有利时期同步,并缓解压力时期,如冬季的寒冷和干旱时期[1, 2]。滞育是许多昆虫在预期压力时进入的一种程序化的休眠策略。从土壤中的种子库到哺乳动物的冬眠,再到滞育的昆虫,代谢抑制是它们休眠的标志之一。大多数昆虫在滞育期间不取食,必须利用休眠前积累的营养储备来满足漫长的休眠期以及休眠后恢复生命周期的分解代谢和合成代谢需求[3, 4]。了解生物体如何在高活跃代谢率和严重代谢抑制之间自然转换,具有广泛的意义,从建立气候变化如何影响休眠生物体的模型,到人工诱导或终止整个生物体的休眠状态,活组织从缺血中恢复,用于移植的体外器官的维护,甚至特定细胞群(如癌症)的代谢操作(如癌症)[5-7]。因此,数十年来休眠期间代谢抑制的调节机制一直是一个热门的研究课题。虽然一些休眠的生物保持相对稳定的低代谢,但其他一些动物,包括一些哺乳动物冬眠和一些滞育昆虫,在强烈的代谢抑制和高代谢活动的短暂爆发之间有规律地波动,这被称为周期性觉醒[5-8]。麦氏麻蝇(Sarcophaga crassipalpis Macquart,双翅目:麻蝇科)在其长达数月的蛹滞育期间表现出显著的代谢抑制,其CO2输出不到非滞育蛹的10%[9]。然而,这种强烈的代谢抑制可以预见地与滞育蛹的觉醒周期交替出现,其中滞育蛹的新陈代谢率接近于非滞育蛹的代谢率[9],类似于某些冬眠哺乳动物中观察到的周期性觉醒周期[5]。
在冬眠的哺乳动物中,周期性的觉醒与多种非互斥的功能有关,包括:补充关键代谢底物,恢复能量状态,清除代谢废物,蛋白质稳态,修复抑制、睡眠和其他一些生理和生化活动造成的损伤[5, 6]。尽管许多转录本、蛋白质和代谢物的丰度变化与周期性觉醒有关[10-13],但对冬眠哺乳动物来说,从抑制中激发代谢兴奋的分子信号尚未被阐明。有人认为,线粒体在周期性觉醒过程中被激活,与线粒体氧化磷酸化相关的关键代谢物的周期性变化可能是代谢周期的根本驱动力[14]。来自其他系统的研究,如芽殖酵母代谢循环(YMC),表明参与氧化还原信号转导的分子丰度的周期变化如还原烟酰胺-腺嘌呤二核苷酸磷酸(NADP[H])和活性氧(ROS),可以调节代谢周期[15-19]。
氧化还原信号早已被认为在昆虫滞育[20]和哺乳动物冬眠中发挥作用[21-23],最近的一项研究表明ROS通过胰岛素信号调节昆虫滞育[24]。ROS的周期性变化与哺乳动物冬眠动物的周期性觉醒周期有关[22, 25],有人提出ROS甚至可能起调节作用[24]。众所周知,过量的ROS会损害细胞功能并导致氧化应激,然而,ROS也被发现是调节细胞能量代谢的重要细胞信号分子,通过与细胞能量代谢的中央调节因子相互作用,例如昆虫和哺乳动物中的缺氧诱导转录因子(HIF)和腺苷5rsquo;单磷酸活化蛋白激酶(AMPK) [26, 27]。然而,在哺乳动物冬眠周期中,ROS大多被认为是应激诱导的副产物,ROS在调节哺乳动物和昆虫的周期性觉醒周期中的作用尚未得到证实。
在滞育过程中,肉蝇蛹依靠有氧脂质分解和厌氧糖酵解的结合来满足能量需求[20, 28],但我们不知道有氧脂质分解和厌氧糖酵解各自对周期性觉醒的贡献程度。我们之前假设,滞育肉蝇蛹在以下两种情况下交替进行:1)在代谢抑制期间,厌氧糖酵解与三羧酸(TCA)循环关闭;2)在觉醒期间,强烈的有氧代谢和代谢产物通过TCA循环流动[20]。考虑到ROS信号在其他昆虫蛹滞育中的重要性[24],我们进一步假设ROS信号通过与缺氧信号的相互作用调节周期性觉醒,并通过代谢产物进入TCA循环激活线粒体呼吸。利用整体代谢组学和基于13C同位素标记的代谢通量分析,我们发现,滞育的肉蝇蛹在代谢抑制期间确实主要依靠厌氧糖酵解和TCA循环关闭,在觉醒期间依靠糖酵解和糖酵解最终产物、脂质和氨基酸的有氧代谢相结合。在觉醒期间关键的厌氧代谢物被清除,包括乳酸和丙氨酸,在厌氧代谢抑制期间被使用的关键的能量代谢物被再生,包括腺苷5 rsquo; -三磷酸(ATP)和海藻糖。我们还发现,低氧信号和AMP:ATP比值在唤醒期间较低,在代谢抑制期间升高,而ROS水平在唤醒期间和代谢抑制早期较高,但随着代谢抑制时间的延长而下降。通过药理学操作,我们证明低ROS水平和高水平的缺氧信号都会触发觉醒,可能是通过关键的门控代谢酶丙酮酸脱氢酶(PDH)和肉碱棕榈酰转移酶1(CPT1)的活性调节丙酮酸进入TCA循环。
结果与讨论
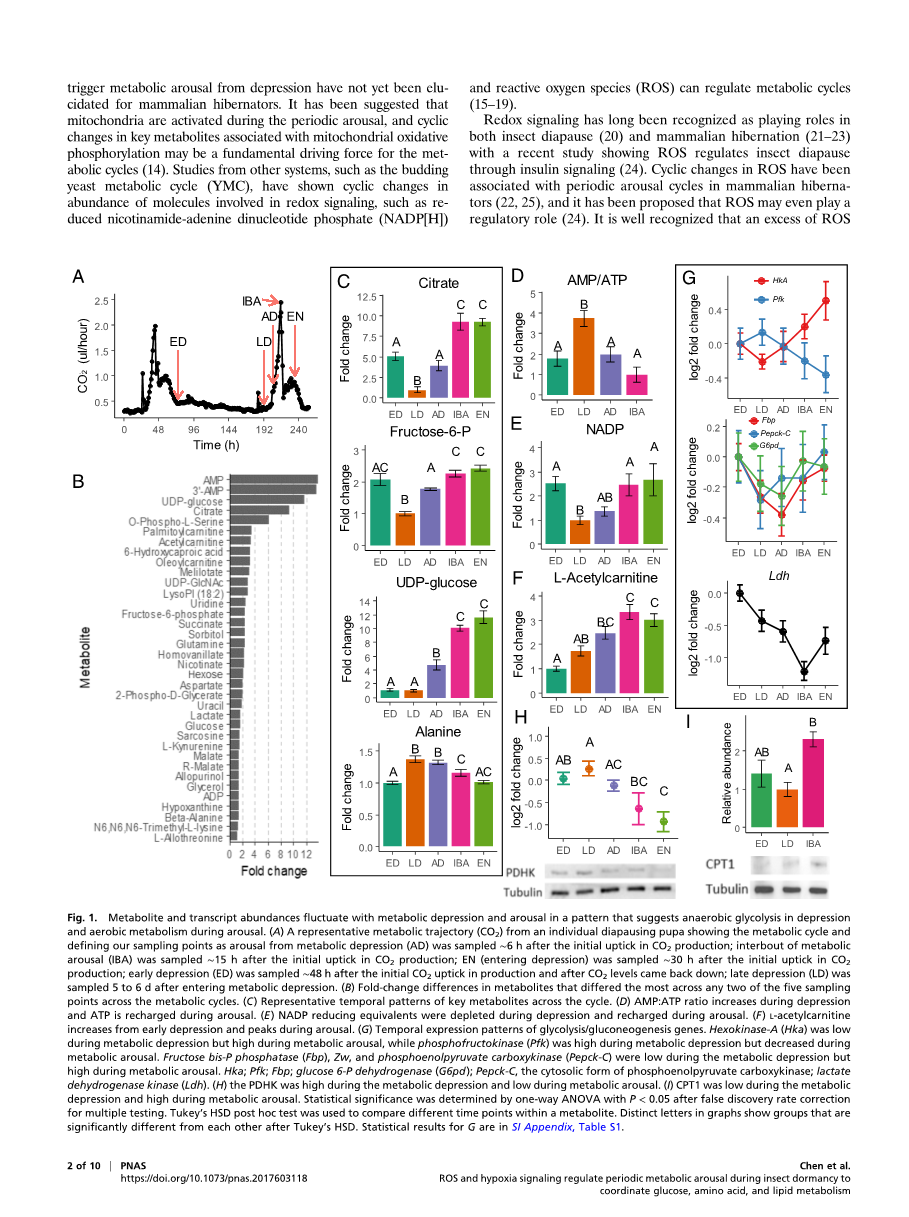
关键的糖酵解和TCA代谢物及其相关酶周期性觉醒。我们的观察结果与之前的研究一致,表明滞育蛹的代谢率不是恒定的,果蝇滞育的特点是代谢抑制期,表现为其产生的CO2仅为非滞育蛹的10%,具有定期的高代谢活动[9](图1A)。这种模式类似于在一些哺乳动物冬眠动物[5]和一些其他滞育昆虫[8]中观察到的代谢觉醒周期。在18°C时,果蝇蛹代谢停滞期在滞育开始时持续3~4 d,滞育中期可延长至8~9 d,但滞育结束时又变短(图1A)[9]。与滞育早期到中期代谢抑制持续时间的变化相反,在18°C的滞育期间,果蝇代谢觉醒阶段持续36~48小时(图1A),每次觉醒都遵循之前描述的可预测结构[9,29]。
通过对冬眠哺乳动物的研究发现,类似的周期性觉醒周期起着关键且非相互排斥的作用,包括但不限于补充代谢抑制、睡眠期间耗尽的关键代谢物、再生生物体的能量状态(即AMP:ATP),维持蛋白质稳态,清除代谢抑制期间积累的厌氧副产物[5,6]。为了揭示滞育果蝇调节周期性觉醒的代谢策略,我们首先从滞育蛹在抑郁和觉醒周期不同阶段的五个时间点获得整体代谢谱(图1A)。通过液相色谱-串联质谱(LC-MS/MS)代谢组学扫描(数据集附录S1),共鉴定出142种代谢物。大多数在周期性觉醒阶段发生显著变化的代谢物与碳水化合物、氨基酸和脂肪酸代谢有关;尤其是糖酵解/糖异生和TCA循环的中间产物(图1B,SI,图S1,和数据集S1)。我们发现这些代谢物在整个循环中有两种主要的丰度模式:1)与氧化磷酸化和糖酵解/糖异生相关的代谢物在代谢抑制期间耗尽,在觉醒期间恢复(例如柠檬酸盐和果糖-6-磷酸)(图1C),2)与无氧代谢相关的代谢物在代谢抑制期间积累(例如丙氨酸和乳酸),但在觉醒后耗尽(图1为丙氨酸和附录SI,图S2A为乳酸)。氧化磷酸化和无氧代谢产物之间的对比模式表明,滞育蛹在觉醒期的有氧代谢和代谢抑制期的无氧代谢之间切换。
与腺苷代谢途径相关的代谢物AMP和3rsquo;-AMP在整个周期中变化最大(图1和附录SI,图S2A)。两者在代谢抑制期都非常高,在觉醒期间都非常低,这表明能量供应在代谢抑制期间受到抑制。另一项有针对性的研究证实了这一点,该研究显示,在抑制期晚期,AMP:ATP比率显著升高(ANOVA, F3,10 = 8.07, P lt; 0.01)(图1D),而许多其他高能分子,如鸟苷三磷酸和尿苷5rsquo;-三磷酸,在整个周期内没有变化(数据集S2)。该靶向分析还发现,与抑制晚期相比,抑制早期、跨期觉醒和进入抑制期时NADP显著升高(F4,15 = 8.07, P lt; 0.005)(图1E)。NADPH是细胞还原当量的主要来源,是许多生物合成反应的底物,保护细胞免受氧化应激。因此,NADP在抑制早期、代谢觉醒和进入抑制期时的积累也表明这些阶段的氧化自由基负荷较高。
尿苷5rsquo;二磷酸(UDP)葡萄糖和柠檬酸盐这两种与糖酵解/糖异生(而非TCA循环)相关的中间产物在整个代谢觉醒周期中也表现出巨大的变化。UDP葡萄糖(F4,40 = 74.32, P lt; 0.001)是糖原和海藻糖[30]的前体,在抑制早期和抑制晚期都较低,但在觉醒期间增加了12倍以上(图1C)。这表明代谢觉醒周期对糖原和海藻糖的再生至关重要,可用于支持代谢抑制期间的无氧糖酵解。以前没有考虑代谢周期的工作表明,滞育果蝇蛹使用糖原和海藻糖作为缺氧代谢的主要能量来源[31],进一步支持在抑制期间从有氧代谢到无氧代谢的转换。从抑制早期到抑制晚期,柠檬酸盐大约减少了五倍,从抑制晚期到跨期觉醒增加了10倍(图1C,F4,40 = 30.30, P lt; 0.001),表明TCA循环在代谢觉醒期间被激活,但在代谢抑制期间没有激活。类似地,与脂肪酸代谢相关的L-乙酰肉碱在代谢性觉醒期间显著增加(F4,40 = 15.28, P lt; 0.001),进一步表明觉醒时向有氧脂质代谢转变(图1F)。
我们的解释是,滞育果蝇主要在代谢抑制期间使用糖酵解,并在觉醒期间运行TCA循环,这一解释也得到了关键代谢酶在整个循环中转录丰度变化的支持(图1,附录SI,表S1)。糖酵解酶SPFK和LDH的转录物丰度在代谢抑制期间较高,但在觉醒期间降低(图1G)。然而,另一种重要的糖酵解酶己糖激酶-A(HkA)表现出相反的模式,在代谢抑制期间转录物较低,在觉醒期间转录物较高(图1G)。与葡萄糖相反的转录物丰度模式指向糖酵解的分支途径(附录SI,图S2B),如海藻糖/糖原合成(由UDP葡萄糖支持,图1C),戊糖磷酸分流(由NADP支持,图1E),和己糖胺合成(由UDP GlcNAc支持,附录SI,图S2A)。两个糖异生相关基因,Fbp 和 Pepck-Cas 的胞质形式以及与通过戊糖产生 NADH 相关的关键酶磷酸分流,G6pd在代谢抑制期间的转录物丰度较低,但在觉
剩余内容已隐藏,支付完成后下载完整资料
英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597845],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、外文翻译、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。