蝗虫微孢子虫在东亚飞蝗中的卵巢传播方式
S.k.Raina.S Das.M.M Rai.A.M Khurad
摘要:蝗虫微孢子虫,一种蝗虫的专性寄生型微孢子虫,能够通过垂直传染给下一代,最高能有效感染到第F14代。每一代中受感染的子代个体相比于未受感染的个体死亡率要高上67.6%至95.5%。受感染的雌性蝗虫中的蝗虫微孢子虫能够通过卵以孢子的形式传染给下一代。当受精卵发育到氮的营养阶段时,蝗虫微孢子开始随着胚胎发育而发育,微孢子主要集中在卵黄和胚胎后部,无论卵黄还是微孢子都被封闭在胚胎中肠中。发芽的微孢子通过感染功能性肠上皮细胞来侵入到内部组织中。在发育过程中,受感染的胚胎组织死亡率很高。
引言:微孢子虫能够通过卵巢垂直传播是为大家众所周知的,这在很多针对微孢子属的研究中被报道。(Brooks 1968; Nordin 1975; Armstrong 1976; Canning1981; Wilson 1982; Han and Watanabe 1988; Bauer andNordin 1989; Pavenstaedt-Grupp and Ruthmann 1989; Pilarskaand Vavra 1991; Sajap and Lewis 1992; Bauer and Pankratz 1993; Novotny and Weiser 1993; Streett et al.1993; Walters and Rami 1993). Canning et al. (1982)指出微孢子能够在蝗虫卵孵化前杀死虫卵,卵巢传播对于虫卵有害,而当虫卵被轻微感染后,才有可能存活至成功孵化。这种蝗虫微孢子虫主要感染蝗虫和蚂蚱的脂肪体(Canning1953; Henry and Oma 1981; Raina et al. 1987), 感染现象也出现在淋巴组织和神经组织中(Henry and Oma 1981).雷纳等人发现微孢子虫也能够侵入到正在发育的飞蝗卵母细胞中(1987),但它进一步的发展和传播途径还没有得到证实。本文主要介绍了蝗虫微孢子虫通过飞蝗卵巢的传播机制。
材料和方法
健康的三龄和四龄的蝗蝻,由在Ambavihar, Nagpur的蚕桑和生物虫害研究管理中心饲养得到。
感染
选择111头四龄的蝗蝻,其中45头雌虫和66头雄虫,饥饿处理24小时,并在塑料小瓶中单独放置。通过向各个龄期的蝗蝻喂食2片1cm见方经过1.5x106个/ml的蝗虫微孢子虫悬浮液浸染处理过的高粱叶。然后将处理过的蝗蝻转移到木制养虫笼中,每个养虫笼的大小为45.8x45.8x61.0厘米,有丝网一侧和滑动玻璃在前面,一个帆布套装在另一侧用以处理蝗虫,并向它们提供新鲜的高粱叶。另外,用未受感染的20头四龄雌虫和20头四龄雄虫作为空白对照组。实验组和对照组的蝗虫均饲养在30℃plusmn;5℃的环境中。实验组昆虫在实验处理13-15天后,随机选取昆虫用针刺后髋关节取淋巴液,制取临时装片,用Giemsa染色处理,验证是否已被蝗虫微孢子虫感染。每日记录,各龄期蝗虫的死亡率。
让未死于微孢子虫感染的雌性蝗虫将卵产在养虫笼中大小一致装有消毒细砂的塑料广口瓶中,每个广口瓶测量8.5x9.0cm的面积。将孵化出的蝗蝻以各笼约50~60头的密度进行饲养。到蝗蝻进入进入第三龄期后开始单独饲养。通过显微镜观察染色后的淋巴液装片以及每个死亡个体制成的匀浆确定感染蝗虫微孢子虫的实验组蝗虫患病率直到F7代仍远高于对照组。根据坎特威尔研究发现(1970)从受感染的F1和F2代个体中统计并收获孢子,死亡率也受感染情况所影响。对实验组和空白对照组间的死亡率进行统计学上的比较。
组织病理
在实验处理13~15天后,随机选取受感染的蝗虫进行解剖处理取其脂肪体和卵巢组织,判断该昆虫的脂肪体和卵母细胞的发育程度。每天收集少量受感染雌性蝗虫产出的卵块进行解剖检查胚胎的发育情况,直到孵化。将解剖的胚胎,卵巢和脂肪体等组织固定在Bouin的流体,用乙醇进行脱水并用二甲苯进行清洗,并嵌入到石蜡中。将嵌入材料的石蜡进行Azan染色进行切片。通过扫描电子显微镜,将收获的孢子转移到粘附在铝制短桩上双胶带上的核孔上,进行脱水干燥后,在涂覆有金钯后用剑桥25 MK.III型扫描电子显微镜进行观察。
结果
实验组的蝗虫在前30天跟对照组相比,其死亡率相差并不显著。但在40天后,发生明显变化,实验组只留下约11%的雌性蝗虫和约9%的雄性蝗虫(如表一)。70天后,所有实验组的蝗虫均已死亡,80天后,空白对照组中仍留有约60%的雄性蝗虫和约75%的雌性蝗虫。相比起对照组实验组蝗虫羽化成成虫和成虫产卵的时间更为延迟。
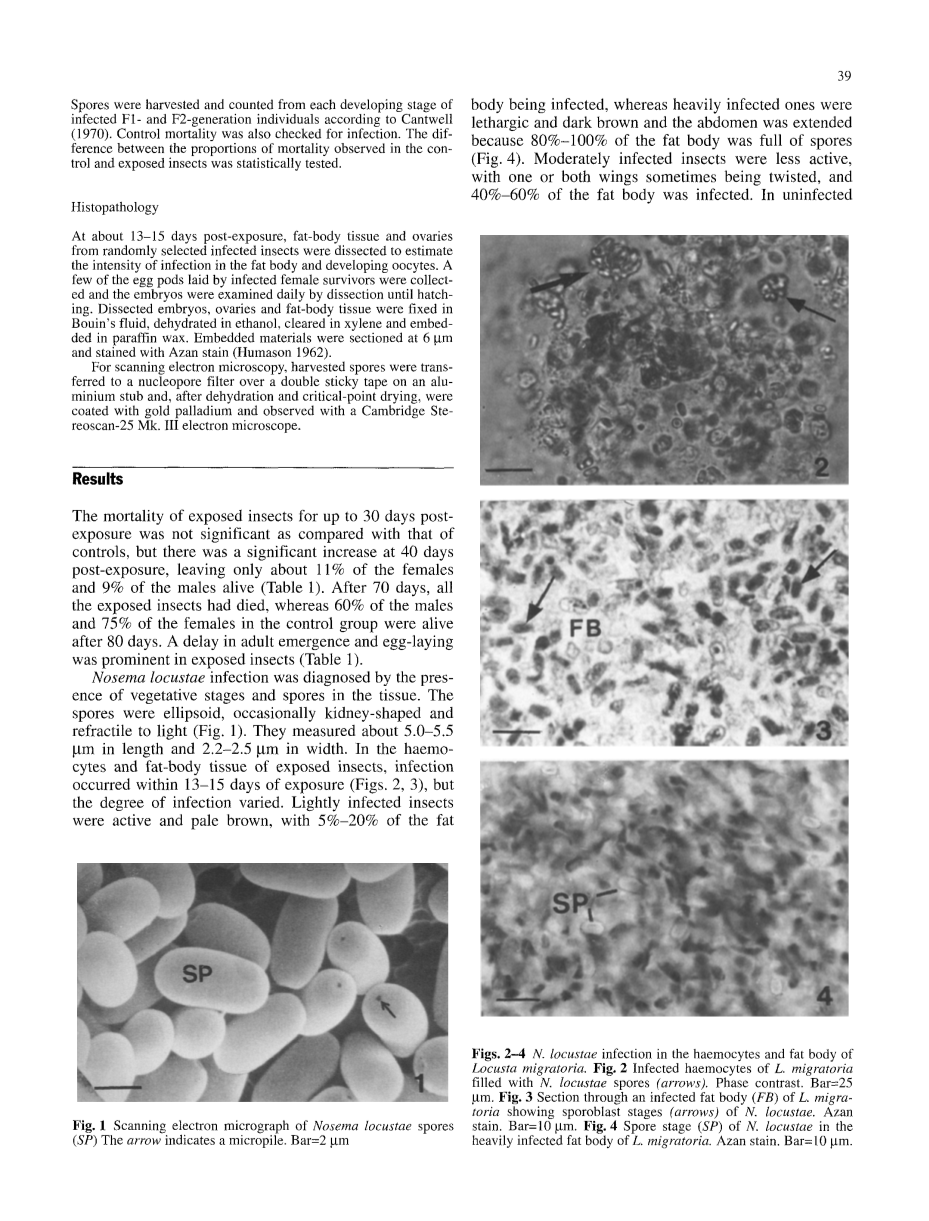
蝗虫微孢子虫在营养阶段被确诊出现,并以孢子的形式存在在在细胞组织中。孢子呈椭圆形,偶尔有肾形,并能够折射光线(如图一)。孢子长约5.0-5.5gm,宽约2.2-2.5gm。在蝗虫的血细胞和脂肪体中,感染现象在13-15天内发生(如图2,3),且逐渐恶化。感染程度较轻的蝗虫活动仍然活跃,脂肪体有5~20%的脂肪体被感染,呈浅棕色,而严重感染的个体无精打采,腹部拉长,脂肪体因为80~100%被感染而呈深褐色(如图4)。中度感染的昆虫活动不太活跃,有一到两个翅出现不正常扭曲,且体内脂肪体有40~60%被感染。未受感染的雌性蝗虫,其卵母细胞发育正常,而严重感染的雌性蝗虫,其卵母细胞通常会发生重吸收现象,轻度感染和中度感染的蝗虫体内,其卵母细胞发育也很正常,虽然大部分卵母细胞携带有处于营养阶段的微孢子(图7-9)。并未在成熟的卵母细胞或是卵细胞中观察到微孢子芽孢的形成(图10)。当胚胎发育处于生殖细胞阶段时,可在该种细胞中观察到微孢子处于营养阶段的形式存在在卵黄之中(图11)。在胚阶段,胚胎旋转180度,胚胎组织感染了微孢子,包括微孢子虫和孢子,发生胚胎的背向闭合(图12)。部分分布在卵黄囊附近的卵黄细胞也被感染(图13)。在中肠上皮细胞形成时,卵黄细胞向外围移动最终分布在中肠上皮细胞之间。一些新近形成的中肠上皮细胞因此感染到微孢子(图14)。受感染的中肠上皮细胞即使在一龄蝗蝻也能被观察到(图15)。严重感染微孢子虫的新进孵化的F1代在孵化后均死亡,而受到轻微感染的个体,则能够存活一段时间,并在之后的龄期或是达到成年后死亡。其中部分(28.4%)则能存活更长的时间,并能够产卵。新一代的死亡率数据表明,死亡率在F2时增加到了95.5%,在之后的几代人后逐渐下降,到了F7代时,其死亡率为82.8%。在F8代时,死亡率进一步下降到67.6%,但在之后的世代中(表2),相比F1和F2世代的个体中的微孢子量,各世代各龄期的微孢子平均量逐渐上升。
讨论
飞蝗的后代饲养到F14后,从实验组亲本一代开始被感染,每一世代由于微孢子虫的持续感染,雌雄蝗虫均有约70%-90%的个体因此死亡。每一代个体中因轻度感染或是中度感染存活下来的个体仍能继续传播微孢子虫。严重感染的雌雄个体大都无法存活到个体成熟,由于卵母细胞发育过程中失活的卵黄原蛋白导致了雌性蝗虫的卵母细胞重吸收现象很频繁。之前的研究发现,蝗虫的脂肪体由于微孢子虫的感染而枯竭(Rains等,1987)。
通常情况下,宿主间微孢子的传播需要宿主摄入微孢子。垂直传播是一种由亲本通过受精卵传染给子一代的方式,是许多昆虫专性微孢子虫的重要传播途径。据Streett等人研究发现(1993),在雏蝗属中微孢子虫通过母体媒介进行垂直传播,其后代70%都会在孵化后5天内感染。而在鳞翅目中,垂直传播的现象已经被许多研究工作人员所发现(Thomson 1958; Nordin 1975; Wilson 1982; Han and Watanabe 1988; Bauer and Nordin 1989; Pilarska and Vavra 1991; Sajap and Lewis 1992; Novotny and Weiser 1993; Walters and Rami 1993),但其在什么时期以何种作用机理寄生到宿主组织中尚未被研究发现。Canning等人(1985)描述冬蛾孢虫在冬蛾世代间经卵巢传播的机制,该微孢子虫的发育晚于胚的发育,虽然微孢子位于卵黄中但不会侵染处于胚胎阶段的幼虫细胞,当孢子积累一定的营养物质后会进行裂殖生殖。当幼虫发育成熟准备孵化时,孢子与卵黄一起被幼虫所摄入。
在飞蝗个体中,微孢子以营养阶段存在在未成熟和成熟的卵细胞中表明,在胚胎发育开始前,孢子的生殖不会发生在发展中的卵细胞中。胚胎发育和孢子卵黄的营养阶段表明,孢子会在特定阶段直接侵染到胚胎组织中并利用其它蛋黄中的脂蛋白,发育成孢子,并继续保持在卵黄中。在胚动后,临时背封将卵黄和孢子一起包围,孢子和临时组织之后通过背侧边缘向外生长形成闭合的生殖细胞。在之后的发展中,卵黄和孢子闭合最终形成了肠上皮细胞。当胚胎准备孵化和中肠已经发育到一定程度具有一定功能,这些孢子将会感染上皮。如果皮下组织被感染且整体感染严重,大部分虫卵将难以孵化,而中度和轻度感染的个体则能存活较长的时间,能够存活至个体成熟,产卵并以此途径将微孢子传播给下一代。图16总结经卵传播的机制和途径,微孢子通过受精卵进入到飞蝗的后代中。
相食在蝗虫和蚂蚱的换羽期最为常见,特别由于脂肪体的感染导致了换羽期的延长,进一步的加剧了相食现象(Henry and Oma 1981)。像F1和F2,这般有大量微孢子感染的个体会向未受到感染的年轻蝗虫传播微孢子,感染大量的蝗虫个体。该微孢子传播方式,通过Bauer and Pankratz (1993)在实验室饲养的三叶叶甲专性微孢子证明具有水平传播和垂直传播两种传播方式。本研究证明,蝗虫微孢子虫能通过水平传播和垂直传播对蝗虫种群能产生长久的影响。
Armstrong E (1976) Transmission and infectivity studies on Nosemakingi in Drosophila wilIistoni and other drosophilids. Z Parasitenkd50:161-165
Bauer LS, Nordin GL (1989) Effect of Nosema fumiferanae on fecundity, fertility and progeny performance of Choristoneura fumiferana (Lepidoptera:Tortricidae). Environ Entomol18:261-265
Bauer LS, Pankratz HS (1993) Nosema scripta, new species (Microsporida:Nosematidae), a microsporidian parasite of thecottonwood leaf beetle, Chrysomela scripta (Coleoptera:Chrysomelidae).J Eukaryote Microbiol 40:135-141
Brooks WM (1968) Transovarian transmission of Nosema heliothidis in the corn earworm, HeIiothis zea. J Invertebr Pathol11:511-512
Canning EU (1953) A new microsporidian Nosema locustae from fat body of the African migratory locust, Locusta migratoria rnigratorioides R and E Parasitology 43:287-290
Canning EU (1981) Insect control with protozoa. In: Papavisas GC (ed) Biological control in crop production. Allanheld Osmunamp;Co., Toronto New Jersey, pp 201-216
Canning EU, Barker RJ, Page AM, Nichoias JP (1982) Speculation on the transmission mechanisms of microsporidia and trypanosomatine flagellate of winter moth, Operophtera brumata (L). J Protozool 29:635
Canning EU, Barker RJ, Page AM, Nicholas JP (1985) Transmissionof microsporidia (Canning, 1960) especially Orthosoma operophterae between generations of winter moth, Operophtera brumata (L) (Lepidoptera:Geometridae). Parasitology90:11-19
Cantwell GE (1970) Standard methods for counting Nosema spores. Am Bee J 110:222-223
Hart MS, Watanabe H (1988) Transovarial transmission of two microsp
剩余内容已隐藏,支付完成后下载完整资料
英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[286601],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、外文翻译、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。