英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
各种苦参碱类似物结构的生物活性和关联
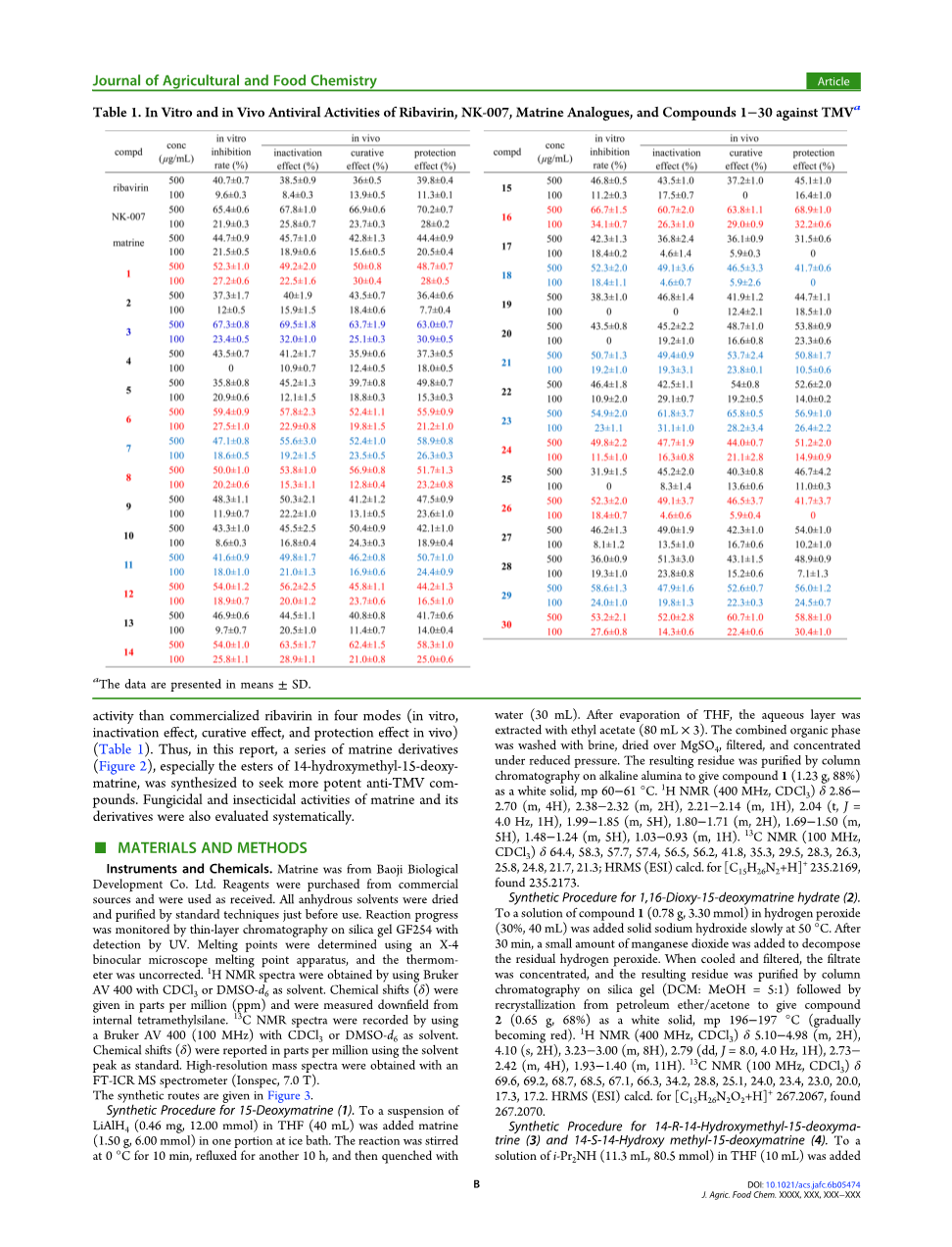
摘要:第一次,报道了植物源天然产物苦参碱对烟草花叶病毒(TMV)的抑制活性比商业的杀病毒剂三唑核苷更有效。在以结构多样性修饰为基础的策略上,合成了一系列苦参碱衍生物,并系统评价了它们对抗TMV,杀真菌活性和杀虫活性的抗病毒活性。结果,化合物3(在体外活性,失活,治疗和体内活性的抑制率分别为67.3%,69.5%,63.7%,63.0%,在500mu;g/ mL条件下),化合物16(66.7%,60.7% ,63.8%,68.9%,在500mu;g/ mL下)和化合物32(74.6%,76.9%,72.3%,75.7%,在500mu;g/ mL下)具有比核 - 病毒(40.8% ,37.5%,38.2%,37.7%,在500mu;g/ mL时)高得多的抗TMV活性,甚至表现出与我们组之前合成的NK-007(在500mu;g/ mL下为70.3%,66.1%,68.4%,67.5%)接近。同时,发现苦参碱及其衍生物具有广谱杀真菌活性(14种真菌),特别是在50mu;g/ mL的浓度下,化合物32对辣椒疫霉的抑制达到96.4%。此外,所有化合物对五种昆虫(包括粘虫,棉铃虫,玉米螟,小菜蛾和淡色库蚊)表现出非常好的杀虫活性;特别是,化合物22的淡色库蚊的抑制率在1mu;g/ mL浓度时仍可达到70%。
关键词:植物来源的天然产物,苦参碱,抗TMV活性,杀真菌活性,杀虫活性,结构活性关系
介绍
苦参碱生物碱包括苦参碱,氧化苦参碱,半胱氨酸和氧代磷酸盐等(图1),是中草药的主要有效成分,如苦参苦豆子和槐木。日本学者首先在1889年从楠木的根部分离苦参,其结构在1936年被Kondo证实。
苦参碱和总生物碱(从某些槐树种提取的总生物碱)被报道具有各种药物活性,例如解热,镇痛和抗炎活性,用于治疗脂多糖诱导的肝损伤。并且它们作为一种植物性农药对自然环境无害,总皂苷也作为商业化广谱杀虫剂(由Kudun命名)。然而,它们的杀虫活性比世界上最常见的农药公司在过去十年中发现的农药杀虫活性低两个数量级。
最近,中国广泛研究了苦参碱类似物的合成和生物活性。然而,大多数研究主要集中于抗肿瘤活性,抗血管生成,抗氧化活性和抗病毒活性; 相比之下,关于农业方面使用(如植物病毒活性,杀真菌活性和杀虫活性)的研究没有那么多。
作为我们一个关于应用天然产品的永久项目,首次评估了植物源产品苦参碱对烟草花叶病毒(TMV)的抑制活性,并且发现苦参碱在四种模式下表现出比商业化的杀病毒剂利巴韦林更高的抗TMV活性(体外,灭活效应,治疗效应和体内保护效应)(表1)。因此,在本报告中,合成了一系列苦参碱衍生物(图2),特别是14-羟甲基-15-脱氧苦参碱酯,以寻找更有效的抗TMV化合物。还系统评价了苦参碱及其衍生物的杀真菌和杀虫活性。
材料和方法
仪器和化学品。苦参碱购自宝鸡生物发展有限公司。试剂购自商业来源,并按收到的原样使用。所有无水溶剂均在干燥条件下,并在使用前通过标准技术纯化。通过硅胶GF254上的薄层色谱监测反应进程,通过UV检测。使用X-4双目显微镜熔点仪测定熔点,未校正热电偶。 1H NMR光谱通过使用具有CDCl 3或DMSO-d 6作为溶剂的Bruker AV 400获得。化学位移(delta;)以百万分之几(ppm)给出,并通过从内部四甲基硅烷低场测量。通过使用具有CDCl 3或DMSO-d 6作为溶剂的Bruker AV 400(100MHz)记录13 C NMR光谱。使用溶剂峰作为标准以百万分率报告化学位移(delta;)。使用FT-ICR MS光谱仪(Ionspec,7.0T)获得高分辨率质谱。
合成路线在图3中给出。
15-脱氧酪氨酸合成程序(1)。在冰浴下向LiAlH 4(0.46mg,12.00mmol)的THF(40mL)悬浮液中一次性加入苦参碱(1.50g,6.00mmol)。将反应在0℃下搅拌10分钟,另外回流10小时,然后用水(30mL)淬灭。蒸发THF后,水层用乙酸乙酯(80mLtimes;3)萃取。将合并的有机相用盐水洗涤,用MgSO 4干燥,过滤,并在减压下浓缩。所得残余物通过碱性氧化铝柱色谱纯化,得到化合物1(1.23g,88%),为白色固体,mp60-61℃。 1 H NMR(400MHz,CDCl 3)delta;2.86-2.70(m,4H),2.38-2.32(m,2H),2.21-2.14(m,1H),2.04(t,J = 4.0Hz,1H) 1.85(m,5H),1.80-1.71(m,2H),1.69-1.50(m,5H),1.48-1.24(m,5H),1.03-0.93(m,1H)。 13 C NMR(100MHz,CDCl 3)delta;64.4,58.3,57.7,57.4,56.5,56.2,41.8,35.3,29.5,28.3,26.3,25.8,24.8,21.7,21.3; HRMS(ESI)计算值[C 15 H 26 N 2 H] 235.2169,实测值235.2173。
1,16-二氧-15-脱氧胸苷水合物(2)的合成方法。
在50℃下向化合物1(0.78g,3.30mmol)的过氧化氢(30%,40mL)溶液中缓慢加入固体氢氧化钠。 30分钟后,加入少量二氧化锰以分解残留的过氧化氢。 冷却并过滤,将滤液浓缩,并将所得残余物通过硅胶柱色谱(DCM:MeOH = 5:1)纯化,然后
从石油醚/丙酮中重结晶,得到化合物
2(0.65g,68%),为白色固体,mp 196-197℃(逐渐
变红)。 1 H NMR(400MHz,CDCl 3)delta;5.10-4.98(m,2H),
4.10(s,2H),3.23-3.00(m,8H),2.79(dd,J = 8.0,4.0Hz,1H)
2.42(m,4H),1.93-1.40(m,11H)。 13 C NMR(100MHz,CDCl 3)delta;
69.6,69.2,68.7,68.5,67.1,66.3,34.2,28.8,25.1,24.0,23.4,23.0,20.0,20.0,
17.3,17.2。 HRMS(ESI)计算值 [C15H26N2O2 H] 267.2067,实测值
267.2070。
14-R-14-羟甲基-15-去氧胸碱(3)和14-S-14-羟甲基-15-去氧胸碱的合成程序(4)。 在-78℃,氩气下,向i-Pr 2 NH(11.3mL,80.5mmol)的THF(10mL)溶液中滴加n-BuLi(37.6mL,2.4M的THF溶液,90.2mL)。 10分钟后,通过注射器缓慢加入碳酸二甲酯(3.5mL,41.9mmol)的THF(10mL)溶液。将反应混合物在该温度下搅拌30分钟,然后自然升温至室温。 两小时后,加入饱和NH 4 Cl水溶液(20mL)以淬灭反应。 蒸发THF后,水层用CH 2 Cl 2(80mLtimes;3)萃取。合并的有机相用盐水洗涤,用MgSO 4干燥,过滤并减压浓缩,得到黄色的混合物A(产率98%) 油。
向上述获得的混合物A无水甲醇(500mL)溶液中加入氯化钙(10.6g,96.6mmol),然后在冰浴中分批加入硼氢化钠(7.30g,193.2mmol)。当回流5小时时,将混合物用20mL水淬灭。蒸发甲醇后,水层用EA(60mLtimes;3)萃取。合并的有机相用盐水洗涤,用MgSO 4干燥,过滤,减压浓缩,得到白色固体B(产率85%)。
在冰浴下向B的无水THF(150mL)溶液中加入氢化铝锂(3.60g,64.40mmol),将混合物回流5小时,然后用水淬灭。蒸发THF后,水层用乙酸乙酯(100mLtimes;3)萃取。将合并的有机相用盐水洗涤,用MgSO 4干燥,过滤,并在减压下浓缩。所得残余物通过碱性铝(二氯甲烷,含1%氨水/石油醚= 1:1)柱色谱纯化,得到化合物3和4。
化合物3:淡黄色固体(3.1g,37%),mp 146-147℃。 1H
NMR(400MHz,CDCl 3)delta;4.02-3.98(m,1H),3.81-3.78(m,1H),
2.93-2.93(m,1H),2.85-2.76(m,2H),2.66(t,J = 12.0Hz,1H) dd,J = 8.0,4.0Hz,1H),2.02
(t,J = 4.0Hz,1H),1.97-1.61(m,13H),1.56-1.34(m,5H)。 13 C NMR
(100MHz,CDCl 3)delta;68.9,64.1,59.6,58.0,57.6,57.3,55.9,41.9,35.3,
33.6,28.9,28.1,27.1,26.1,21.6,21.3。 HRMS(ESI)计算值对于
[C 16 H 28 N 2 O H] 265.2274,实测值265.2276。
化合物4:黄色固体(3.0g,35%),mp 146-147℃。 1 H NMR
(400MHz,CDCl 3)delta;3.48-3.39(m,2H),3.38(s,1H),2.95(d,
12.0Hz,1H),2.97-2.71(m,3H),2.40-2.32(m,2H),2.04(s,1H)
1.97-1.63(m,10H),1.54-1.29(m,6H),1.10-0.93(m,2H)。 13C
NMR(100MHz,CDCl 3)delta;66.1,64.2,59.5,58.3,57.6,57.4,56.1,41.4,
39.1,35.1,28.9,28.2,27.8,26.5,21.7,21.3。 HRMS(ESI)计算值对于
[C 16 H 28 N 2 O H] 265.2274,实测值265.2278。
14-R-14-氯甲基-15-脱氧肉碱的合成方法(5)。 在室温下向化合物3(0.52g,2.0mmol)和CH 2 Cl 2(40mL)的溶液中滴加亚硫酰氯(0.21g,3.0mmol)。 将反应混合物回流2小时后,用稀Na 2 CO 3水溶液,水和盐水洗涤。 之后溶液用Na 2 SO 4干燥,减压蒸发,所得残余物通过碱性氧化铝柱色谱纯化,得到化合物5(0.48g,86%),为白色固体,mp 108-109℃。 1 H NMR(400MHz,CDCl 3)delta;3.84-3.67(m,2H),2.86-2.76(m,3H),2.66(t,J = 12.0Hz,1H),2.37-2.31 dd,J = 8.0,4.1Hz,1H),2.01-1.86(m,7H),1.81-1.48(m,6H),1.44-1.25(m,4H),1.11-1.00(m,1H)。 13 C NMR(100MHz,CDCl 3)delta;64.4,58.5,57.8,57.6,57.4,56.1,47.2,41.5,36.8,35.1,28.3,26.5,26.2,24.8,21.8,21.4。 HRMS(ESI)计算值 [C 16 H 27 ClN 2 H] 283.1936,实测值283.1940。
14-S-14-氯甲基-15-脱氧巴豆碱的合成方法(6)。 使用类似于化合物5的合成方法得到化合物6,为白色固体(0.58g,71%),mp 57-58℃。 1 H NMR(400MHz,CDCl 3)delta;3.43-3.31(m,2H),3.00(d,J = 8.0Hz,1H),3.01-2.76(m,3H),2.42-2.34(m,2H) 1.89(m,9H),1.78-1.60(m,2H),1.55(s,2H),1.46-1.31(m,4H),1.11-0.96(m, 13 C NMR(100MHz,CDCl 3)delta;64.2,59.8,57.9,57.6,57.3,56.0,48.2,41.6,38.7,35.6,29.1,29.0,28.1,26.5,21.7,21.3。 HRMS(ESI)计算值 [C 16 H 27 ClN 2 H] 283.1936,实测值283.1940。
14-R-14-甲基磺酰氧基甲基-15-脱氧胸苷的合成方法(7)。向化合物3(0.69g,2.6mmol)
和CH 2 Cl 2(40mL)中的溶液中滴加甲磺酰氯(0.59g,5.2mmol)。将反应混合物在室温下搅拌约2.5小时后,用稀NaHCO 3水溶液,蒸馏水和盐水洗涤。溶液用无水Na 2 SO 4干燥后,减压蒸发,所得残余物通过碱性氧化铝柱色谱纯化,得到化合物7,为白色固体(0.94g,80%),mp106-107℃ 。 1 H NMR(400MHz,CDCl 3)delta;4.48-4.35(m,2H),3.02(s,3H),2.84-2.65(m,4H),2.39-2.34(m,2H) ,4.0Hz,1H),2.10-2.08(m,1H),2.01(t,J = 4.0Hz,1H),1.93-1.70(m,7H),1.60-1.49 m,5H),1.13-1.02(m,1H)。 13 C NMR(100MHz,CDCl 3)delta;71.6,64.2,58.3,57.6,57.4,56.5,56.0,41.5,36.9,35.1,33.4,28.2,26.2,25.1,24.9,21.7,21.3。 HRMS(ESI)计算值[C 17 H 30 N 2 O 3 S H] 343.2050,实测值343.2058。
14-S-14-甲基磺酰氧基甲基-15-脱氧胸苷的合成方法(8)。化合物8通过使用化合物4作为底物并采用与化合物7类似的合成方法制备。为白色固体(0.92g,90%),mp110-112℃。 1 H NMR(400MHz,CDCl 3)delta;4.11-3.98(m,2H),3.01(s,3H),2.94-2.91(m,1H),2.84-2.74(m,3H),2.40-2.34 ),2.05-2.04(m,2H),1.99-1.84(m,7H),1
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[138793],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、外文翻译、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 莲NnWRKY基因在激素条件下的表达谱研究开题报告
- 使用转录组学分析阐明5-氨基乙酰丙酸在谷氨酸棒杆菌上的积累产生的生理效应外文翻译资料
- 基于网络药理学的水仙抗肺癌作用研究外文翻译资料
- 灵敏简便的仿生纳米酶免疫吸附比色法和表面增强拉曼效应检测 triazphos外文翻译资料
- LONELYGUY基因家族:从苔藓到小麦中生成植物活性细胞分裂素的关键基因外文翻译资料
- 葛根提取物可保护由过氧化氢引起的人视网膜色素上皮细胞死亡和膜通透性改变外文翻译资料
- 从人参中分离的内生细菌可促进生长、降低发病率并刺激人参皂苷生物合成外文翻译资料
- 拟南芥根表皮细胞命运的调控:多重反馈环的重要性外文翻译资料
- 根毛模式及形态发生的调控及可塑性外文翻译资料
- 拟南芥根表皮细胞分化的基因调控网络外文翻译资料