英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
荧光标记Thailanstatin抗体药物偶联物的细胞迁移研究发展
Chethana Kulkarni, James E. Finley, Andrew J. Bessire, Xiaotian Zhong, Sylvia Musto, and Edmund I. Graziani
摘要:随着抗体-药物偶联物(ADC)对于癌症的治疗越来越重要,研究人员必须建立对ADC如何在分子水平上起的作用的坚定的理解。为了获得ADC吸收,转运和分解代谢过程的深入了解,这些过程对ADC功效和毒性成像的研究至关重要,现在已经用荧光标记物来标记其共轭物。然而,这样的标记物可能会改变正在研究的ADC的属性和行为。作为代替的方法,我们在这里介绍一种“可点击”ADC的开发,该ADC具有准备与炔炔荧光团进行“点击”反应的叠氮官能化接头-有效载荷(LP);与大多素荧光团相比,叠氮基代表了比LP明显更小的结构扰动。值得注意的是,“可点击”的ADC在靶细胞表达中显示出优异的效力,而荧光基团标记的产物ADC具有显著的活性损失,这强调了标签本身对有效载荷的影响。活细胞共聚焦显微镜显示“可点击”ADC的强大摄取力,其可以用衍生化的荧光标记选择性原位反应。时间过程的转运研究显示,ADC比母体抗体有更大更快速的内化运输网。更广泛地说,化学生物学工具在ADC研究中的应用应该能够提高我们对于如何在生物系统中处理ADC的理解。
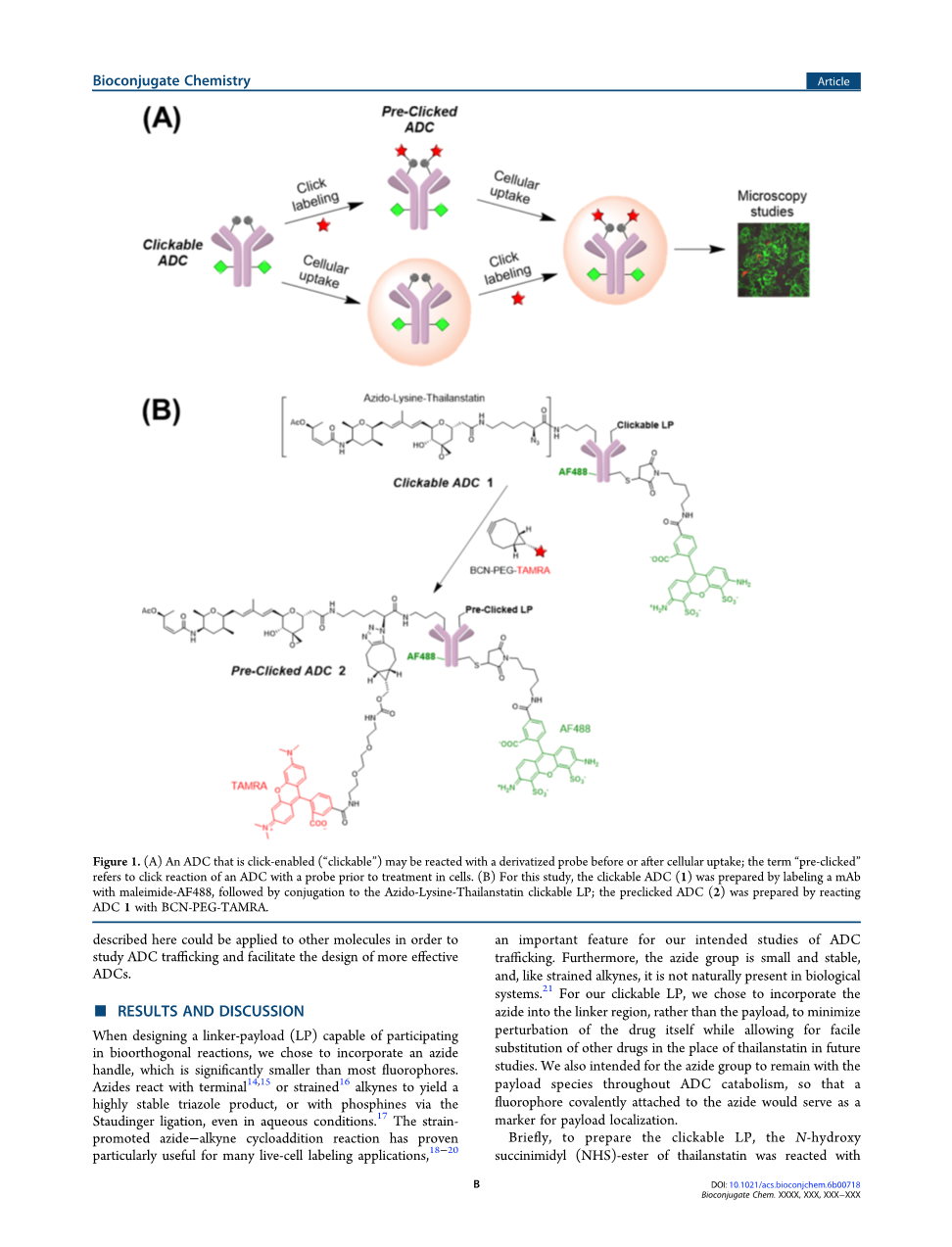
引言:抗体-药物偶联物(ADC)形成了肿瘤学靶向治疗药物的有希望且快速增长的领域。通过将抗体的特异性和所需的药代动力学特征与细胞毒性小分子的效力相结合,ADC提供了一种比目前的护理标准更有效的癌症治疗方法。目前,有两种FDA批准的ADC可用于患者,分别是Adcetris(brentuximab vedotin)和Kadcyla (ado-trastuzumab emtansine),另外还有50种ADC在临床开发的不同阶段。这些缀合物绝大多数使用微管抑制剂,其在快速增殖的细胞中表现出非常好的细胞毒性, 但对缓慢分裂的细胞效果较差。对于目前的研究,我们重点关注thailanstatin类化合物,其通过抑制剪接体3,4起作用并在增殖和非增殖癌细胞中表现出优异的效力。除了具有分化的作用机制之外,thailanstatins对一些多药耐药细胞也有效。给定ADC的相对功效和毒性在很大程度上取决于释放有效载荷的位置和时间; 这些因素反过来又取决于吸收,转运,和ADC的分解代谢。关于这些关键过程和组织,细胞和血浆中有效载荷药物的最终命运,还有许多问题。为了解决这些问题,已经用抗体和用荧光团或PET试剂标记的ADC进行了成像研究。虽然这些研究在阐明转运途径方面非常丰富,但是关于标签本身对正在研究的抗体或ADC的结构和性质的影响仍然存在疑虑。因此,对于目前的工作,我们使用生物正交“点击”化学,这允许在生物系统中以精湛的选择性进行原位标记(图1A)。这里,我们描述一个可点击thailanstatin ADC(1)带有最低限度修饰,使能clickchemistry - 接头 - 有效载荷的开发和评估; 该ADC可以与衍生的荧光团反应以产生“预先点击”的ADC(2)(图1B)。除了目前的研究之外,这里描述的方法可以应用于其他分子,以便研究ADC转运,并促进设计更有效的ADC。
图1.(A)在细胞摄取之前或之后,可点击启用(“可点击”)的ADC与衍生化的探针反应; 术语“预先点击”是指在细胞处理前,ADC与探针的点击反应。 (B)对于本研究,通过用马来酰亚胺-AF488标记mAb来制备可点击的ADC(1),然后与叠氮基 - 赖氨酸 - 赖氨酸稳定可点击的LP缀合; 通过ADC 1与BCN-PEG-TAMRA反应来制备预先引入的ADC(2)。
结果和讨论:当设计能够参与生物正交反应的接头 - 有效载荷(LP)时,我们选择纳入叠氮处理,这比大多数荧光显著小。即使在水性条件下,叠氮化物与末端或应变炔反应以产生高度稳定的三唑产物,或通过Staudinger连接与膦进行反应。已经证明应变放大的叠氮炔环加成反应对于许多活细胞标记应用是特别有用的,这是我们对ADC转运的预期研究的重要特征。此外,叠氮基团小而稳定,像应变炔一样,它不是天然存在于生物系统中。对于我们的可点击LP,我们选择将叠氮化合物并入接头区域而不是有效载荷,以最大限度地减少药物本身的扰动,同时允许在未来的研究中轻松替代其他药物代替thailanstatin。我们还希望叠氮化合物在ADC分解代谢中保持有效载荷物种,从而共价连接到叠氮化物上的荧光团将作为有效载荷定位的标记。简言之,为了制备可点击的LP,在Hunig碱的存在下,thailanstatin的N-羟基琥珀酰亚胺基(NHS) - 酯与叠氮基 - 赖氨酸反应。 得到的游离酸用于五氟苯基(PFP)酯活化,得到所需的PFP-叠氮基 - 赖氨酸 - 泰兰抑素LP(3)(方案1,SI图S1A)。如详细的合成方法(SI材料和方法)所述,还制备和表征了NH活化的叠氮基 - 赖氨酸 - 泰兰抑素LP(SI图S1B)。然而,它快速水解为游离酸,使其对抗体缀合无效。
为了制备可点击的ADC1,将曲妥珠单抗突变体抗体标记并与LP 3缀合。我们选择使用曲妥珠单抗用于我们的研究,因为在该抗体上产生的ADC的结构和生物学特性被良好表征。我们使用的突变体抗体在重链中具有允许位点特异性半胱氨酸缀合的突变,并且轻链(kappa;D185A)中的第二突变允许位点选择性赖氨酸共轭。在标准还原/再氧化程序之后,首先用马来酰亚胺Alexa Fluor 488(AF488)标记抗体,以使得能够跟踪独立于LP的抗体。另外,可点击的ADC 1的一部分与BCN-PEG-TAMRA25反应以产生双标记的预先点击的ADC 2,其作为成像研究中的重要控制。
为了确定正在研究的ADC的荧光团 - 抗体比例和药物 - 抗体比(DAR)值,在任何共轭反应之前,通过LC-MS表征mAb,再次用马来酰亚胺-AF488标记后缀合至LP 3产生可点击的ADC 1,最后与BCN-PEG-TAMRA反应后制备预先点击的ADC 2。(代表质谱分别在SI图S2A,S3A,S4A和S5A中给出)光谱质量与预期质量的比较(SI表S1)显示荧光团抗体比值和DAR值为2。重要的是,预先标记的ADC 2的质谱显示可点击的LP与BCN-PEG-TAMRA以定量的产率反应,表明叠氮部分在完整的ADC中是可达到的。通过尺寸排阻色谱(SEC)的表征证实在任何阶段都没有发生聚集(SI图S2B,S3B,S4B和S5B)。
图2.溶酶体降解测定显示,可点击的ADC 1和预先点击的ADC 2的释放物质是Lys-封闭的完整接头 - 有效载荷。
图3.用(A)可点击的ADC1或(B)预先点击的ADC 2处理SKOV3细胞,并在共聚焦显微镜上成像。 30分钟,4小时或24小时ADC处理后的活细胞成像显示在30分钟内结合,并在24小时内对两种ADC进行稳定摄取。 预先点击的ADC 2 mAb和有效载荷信号的高度叠加在所有3个时间点都是可见的。 (mAb用AF488标记;有效载荷用TAMRA标记用于预先标记的ADC 2;面板(A)中的比例尺适用于所有图像。)
通过可点击的ADC 1和预先标注的ADC 2,我们试图评估ADC在靶表达细胞中的体外活性。特别是,我们有兴趣了解更多关于叠氮化物接头,TAMRA标签和AF488标签对ADC功效的潜在影响。在表达Her2的N87细胞系中,IC 50值的测量非常好地显示可点击ADC1的效力,与类似的thailanstatin缀合物显示的效力相当,因此表明叠氮部分不损害ADC活性。相比之下,预先点击的ADC 2比具有等效DAR值的可点击ADC 1(表1)的活性要低约200倍,表明TAMRA标签确实干扰ADC功能。重要的是,马来酰亚胺-AF488标签对ADC活性没有显着的影响,在母体化合物1的3倍内观察到可测量的ADC中没有观察到AF488标签的IC 50。在不表达Her2的阴性对照HT29细胞中,所有ADC产生大于1000nM的IC 50值,证明如预期的那样,在N87细胞中观察到的活性特异性依赖于靶标介导的ADC吸收(SI 的材料和方法)。
如前所述,我们的可点击LP 3的设计目标之一是叠氮化物组,并且任何与其连接的荧光团保留在有效载荷上,从而作为细胞中有效载荷定位的标记。该设计目标与先前报道的具有与没有接头直接缀合赖氨酸的thailanstatin有效载荷的ADC的观察结果一致; 具体来说,用于这种ADC的释放物质是完全由ADC分解代谢产生的thailanstatin-赖氨酸共价加合物。为了鉴定目前工作中ADCs分解代谢后的释放物种,进行溶酶体降解测定。简言之,将可点击的ADC1和预先点击的ADC 2分别在人类肝脏S9级分培养,并在24和48小时后取出样品并进行LC-MS分析淬灭。结果表明,24小时后,两个ADC中LP的释放物质都包括叠氮化物手柄,无反应(ADC 1)或与BCN-PEGTAMRA(ADC 2)反应(图2,SI图S6A,S6B,S6C ,S6D和S6E)。虽然不可能直接测量这些释放物的细胞毒性,但由于其低的细胞通透性,我们假设来自预先敲入的ADC 2的释放物中的TAMRA荧光团的额外空间体积可能干扰与SF3b亚基结合的剪接体。其中省略的S9部分的阴性对照反应没有显示任何ADC的信号,证实降解取决于S9溶酶体酶的存在(SI图S6F)。另外,两种ADC都鉴定了由Cyscapped AF488释放的mAb降解产生的物质(SI图S6G); 再次证实了阴性对照反应,只有当S9分数存在时才观察到释放的物质(SI图S6H)。
与可点击ADC 1和预点击ADC 2完全表征,共聚焦成像研究由表达Her2的SKOV3细胞引发。时程成像实验表明,两个ADC在30分钟内结合细胞表面; 在4 h内观察到部分摄取,24 h标记可见完全摄取(图3)。这些研究还表明,与预先点击的ADC 2相关的低活性不是由ADC摄取不良引起的; 实际上,这些结果与我们的假设一致,即N87细胞中预先点击的ADC的活性降低是释放物质与其细胞内靶标的固有降低的结合的结果。值得注意的是,ADC 2的合并图像显示了所有时间点的抗体和有效载荷信号的完整覆盖。 尽管不可能从这些数据中得出结论:抗体和有效载荷组分保持共价连接,但显然它们保持共定位。
接下来,我们试图解决我们系统中的一个关键问题:可点击的ADC 1是否可以参与活细胞中的突变点击反应。 在用ADC1或阴性对照处理24小时后,将Tras-AF488,SKOV3细胞暴露于BCN-PEG-TAMRA,洗涤并成像(图4A,B)。 如相应的共聚焦图像所证明的,可点击的ADC 1与环辛烯染料BCN-PEG-TAMRA在原位和选择性地反应。 在整个视场独立定量分析显示,用BCN-PEG-TAMRA处理后,ADC1与阴性对照Tras-AF488之间的平均TAMRA信号差异为12倍(图4C)。
在确定了ADC 1的活细胞标记后,我们进行了时间过程成像研究,以检查TrasAF488,ADC 1和ADC 2之间细胞摄取的相似性和差异。我们也对这三个标记的叠加具有溶酶体信号的分子,因为大部分发生内吞作用的分子的最终命运是溶酶体中的降解。荧光标记的葡聚糖分子长期以来一直用作内吞作用的标记物,并且取决于孵育时间,特别是溶酶体。 为了验证葡聚糖 - Alexa Fluor 647(葡聚糖-AF647)作为我们系统中的溶酶体标记,我们将其与免疫细胞化学(ICC)研究中的LAMP1抗体染色进行比较,发现信号之间的高度重叠(SI图S7)。对于Tras-AF488,ADC 1和ADC 2的时间过程实验,我们专注于mAb /溶酶体共定位。 通过独立实验收集的显微镜图像的定量分析表明,两个ADC的流量非常相似,并且都比Tras-AF488显示出更大和更快的净内部化(图5)。 这些结果表明,相对于亲本抗体,ADC1和2优先经历针对溶酶体而不是循环到细胞表面。 鉴于预先标记的ADC 2被内化并以与可点击ADC 1相似的速率到达溶酶体,相对于1的活性降低也可能是由于2的释放物质不能逸出溶酶体并进入细胞质 。 因此,我们着手确定每个ADC的释放物种的最终命运是否可以确定。
进行延长的时间过程研究,其中SKOV3细胞用Tras-AF488,ADC 1或ADC 2处理96小时,然后成像(SI图S8)。 我们观察到所有三个分子的AF488信号的显着持续性,以及ADC 2的抗体(AF488)和有效载荷(TAMRA)组分之间的高度重叠。即使在96小时后,TAMRA信号在溶酶体中的持续性表明 ADC 2释放物种内的荧光标签的存在可以抑制溶酶体膜中氨基酸(赖氨酸)转运蛋白的摄取。基于成像结果的总体显示,我们假设ADC 1和ADC 2之间的活动差异很大可能是由于每个ADC的释放物种的溶酶体逃逸和/或靶标接合的差异。 未来研究将使用更专门的实验策略,例如无细胞剪接体测定或复杂的荧光显微镜/电子显微镜仪器,可以揭示这些假设的有效性。
总之,我们设计和开发了一种新型的基于thailanstatin的ADC,其具有点击反应性连接体有效载荷,以实现ADC的原位荧光标记。 独特的双突变曲妥单抗体允许在Cys位点用AF488标记对mAb进行独立标记,并在Lys位点与含叠氮化物的PFP活化的thailanstatin LP缀合。 在体外活性研究中,可点击的ADC1在Her2表达细胞中表现出非常好的效力,但是向ADC1加入BCN-PEGTAMRA标记,产生ADC 2,导致活性丧失200倍。这种巨大的差异性强调了检查荧光标记可能对mAb或ADC,特别是LP部分的影响的重要性。 活细胞成像研究显示两种ADC都具有强烈的摄取作用,定量图像分析显示ADC与Tras-AF488的净内化程度更大,如溶酶体重叠所证明。 重要的是,即使在复杂的细胞环境中,可点击的ADC 1也能够与环状星形探针发生反应,这表明可以采用类似的基于点击化学的方法来
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[138804],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、外文翻译、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 莲NnWRKY基因在激素条件下的表达谱研究开题报告
- 使用转录组学分析阐明5-氨基乙酰丙酸在谷氨酸棒杆菌上的积累产生的生理效应外文翻译资料
- 基于网络药理学的水仙抗肺癌作用研究外文翻译资料
- 灵敏简便的仿生纳米酶免疫吸附比色法和表面增强拉曼效应检测 triazphos外文翻译资料
- LONELYGUY基因家族:从苔藓到小麦中生成植物活性细胞分裂素的关键基因外文翻译资料
- 葛根提取物可保护由过氧化氢引起的人视网膜色素上皮细胞死亡和膜通透性改变外文翻译资料
- 从人参中分离的内生细菌可促进生长、降低发病率并刺激人参皂苷生物合成外文翻译资料
- 拟南芥根表皮细胞命运的调控:多重反馈环的重要性外文翻译资料
- 根毛模式及形态发生的调控及可塑性外文翻译资料
- 拟南芥根表皮细胞分化的基因调控网络外文翻译资料