英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
应用形态学重建和聚类自动检测巴氏涂片图像中的细胞核
Marina E. Plissiti,Christophoros Nikou,IEEE会员和Antonia Charchanti
摘要:本文提出了一种全自动的巴氏涂片图像细胞核检测方法。通过形态学分析检测图像中候选核质心的位置,并且在第二步骤中,结合了关于每个核的周长的先验知识,对它们进行精制。消除不希望的伪像是通过两个步骤实现的:在所产生的质心上应用距离依赖规则;和分类算法的应用。在我们的方法中,我们已经检验了不可见的(模糊C均值)和监督(支持向量机)分类技术的性能。在两种分类技术中,细化步骤的效果改善了聚类算法的性能。该方法采用38张含有5617个公认的鳞状上皮细胞的常规巴氏涂片的细胞学图像进行评估。即使在具有高度细胞重叠的图像的情况下,结果也是非常有理想。
索引术语:细胞核检测,模糊C均值(FCM),形态重建,巴氏涂片图像,支持向量机器(SVM)
- 简介
对细胞和组织的显微镜检查的正确解释对于许多疾病的最终诊断决定是至关重要的。 显微镜筛选最有趣的应用领域之一是检测细胞样品中的癌症前体。 如今,最着名的例子是通过众所周知的巴氏涂片[1]在早期阶段筛查宫颈癌。
巴氏涂片图像的视觉解释是繁琐,耗时的,并且在许多情况下是容易出错的过程。 这是传统涂片表现出不均匀的分层,拥挤和细胞重叠这一事实的结果。 此外,由于染色过程,细胞的光照和染料浓度存在差异。 此外,还有许多变量,如空气干燥,过多的血液,粘液,细菌或炎症,这使得识别可疑细胞成为一项艰巨的任务。
每个巴氏涂片图像包括的大量细胞和细胞类型的变化也是复杂性的因素。 在巴氏涂片图像上通常可见三种类型的鳞状细胞:
- 浅表细胞是三者中最大的,并且具有小的致密核和细胞质,通常染色嗜酸性(红色);
- 中间鳞状细胞,其外观相似但尺寸略小,具有较大的,结构清晰的圆形细胞核,细胞质通常染成嗜碱性(蓝色);
- 副基底细胞类型更小,更圆,细胞类型不成熟。
进一步处理这些图像的先决条件是细胞核的自动检测,当细胞受疾病影响时,细胞核呈现显着变化。 在病理情况下,细胞核可能表现出不成比例的扩大,形态和轮廓不规则,色素沉着过度或染色质浓缩不均匀。 核的形态和密度的这些变化的鉴定和量化有助于区分正常细胞和异常细胞
首次尝试在宫颈显微图像中检测和分割细胞是基于图像阈值技术[2]。 此外,还提出了像素分类用于宫颈图像的分割[3]。 另一类方法涉及形态分水岭,用于分离细胞质和每个细胞的细胞核[4],[5]。 细胞结构元素的边界可以通过采用基于活动轮廓的方法[6],模板拟合[7],[8],遗传算法[9],用移动K均值生长的区域[10]来获得。 ]和边缘探测器[11],[12]
在表1中,给出了文献中出现的用于分割巴氏涂片图像的方法。 可以观察到,许多方法没有利用宫颈图像的颜色信息,通过将彩色图像转换为灰度对应物[4],[6] - 12],因此,缺少颜色信息。 此外,在许多方法中没有考虑到细胞重叠的问题,这些方法确定了仅包含一个细胞或分离细胞的宫颈图像中的细胞核和细胞质的边界[4],[6],[9],[11] ,[12]
表1、用于子宫颈抹片检查细胞核测定的方法的优点和局限性
|
提出的方法 |
提出年份 |
优点 |
缺点 |
|
参考文献[4] |
1996 |
|
|
|
参考文献[6] |
1998 |
|
|
|
参考文献[7] |
1998 |
|
|
|
参考文献[8] |
2000 |
|
|
|
参考文献[5] |
2002 |
|
|
|
参考文献[9] |
2003 |
|
|
|
参考文献[3] |
2004 |
|
|
|
参考文献[10] |
2005 |
|
|
|
参考文献[12] |
2008 |
|
|
|
参考文献[11] |
2009 |
|
|
考虑到这些方法所基于的一般方法,我们可以得出结论,数学形态学为图像分割提供的强大技术未被有效利用。即使在[4]和[5]中使用形态分水岭的情况下,这些方法似乎也受到一些限制。 Bamford和Lovell [4]提出的方法应用于低分辨率的灰度图像,并导致识别每个图像中孤立细胞的位置。然而,未检测到细胞簇中的细胞核。此外,Lezoray和Cardot [5]提出的方法基于用于检测核标记的像素分类技术,以避免分水岭算法可能产生的过度分割。在像素分类技术中,像素所属的类的数量的选择对于最终分割结果起着至关重要的作用。子宫颈抹片检查图像表现出极大的复杂性,像素类的数量并不明显。将图像的所有像素分布为两个类(例如核像素和其他像素)的粗略假设会产生噪声结果
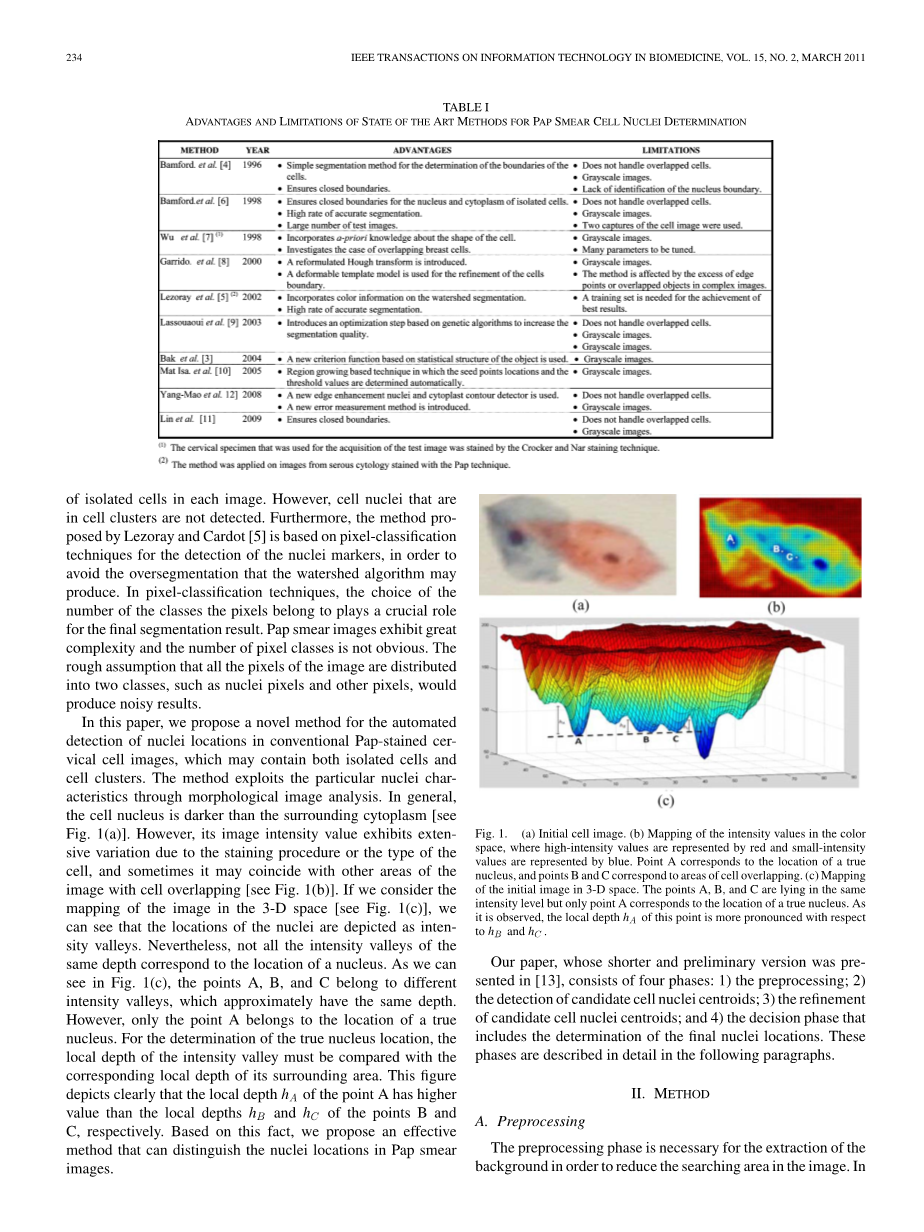
在本文中,我们提出了一种新的方法,用于自动检测常规巴氏染色宫颈细胞图像中的核位置,其可能包含分离的细胞和细胞簇。该方法通过形态学图像分析利用特定的核特征。通常,细胞核比周围的细胞质更暗[见图1(a)]。然而,其图像强度值由于染色程序或细胞类型而表现出广泛的变化,并且有时它可能与具有细胞重叠的图像的其他区域一致[见图1(b)]。如果我们考虑图像在三维空间中的映射[见图1(c)],我们可以看到核的位置被描绘为强度谷。然而,并非所有相同深度的强度谷都对应于核的位置。正如我们在图1(c)中所看到的,点A,B和C属于不同的强度谷,其大致具有相同的深度。但是,只有A点属于真核的位置。为了确定真核位置,必须将强度谷的局部深度与其周围区域的相应局部深度进行比较。该图清楚地描绘了点A的局部深度hA分别具有比点B和C的局部深度hB和hC更高的值。基于这一事实,我们提出了一种有效的方法,可以区分巴氏涂片图像中的核位置。
图1.(a)初始细胞图像。
(b)颜色空间中强度值的映射,其中高强度值由红色表示,小强度值由蓝色表示。 点A对应于真核的位置,点B和C对应于细胞重叠的区域。
(c)在三维空间中绘制初始图像。 点A,B和C位于相同的强度水平,但只有点A对应于真核的位置。 如所观察到的,该点的局部深度hA相对于hB和hC更明显。
我们的论文在[13]中提出了较短的初步版本,包括四个阶段:1)预处理; 2)候选细胞核质心的检测; 3)候选细胞核质心的细化; 4)决定阶段,包括确定最终的核位置。 以下段落详细描述了这些阶段
- 方法
A、预处理
预处理阶段对于提取背景是必要的,以便减少图像中的搜索区域。 在第一步中,对于对比度增强和边缘锐化,对比度受限的自适应直方图均衡[14]被单独应用于每个颜色分量。 接下来,从每个滤波图像,使用Otsu [15]提出的方法通过全局阈值化产生二值图像。 最后,在第三步中,二进制掩码BW,包括图像的感兴趣区域,由以下公式:
(1)
其中BW1,BW2和BW3是初始图像的红色,绿色和蓝色通道中的二进制掩码。 然后进行形态学扩张以扩展感兴趣区域的边界,即:
(2)
其中X是一个3X3扁平结构元素。 在该操作之后,不希望具有小于隔离单元区域的面积的连接组件。 出于这个原因,我们删除了面积小于500像素的所有连通分量,这个值小于孤立单元的面积(通常在900times;像素之间变化,经细胞病理学家仔细检查后确定) )并且大于小物体的大小。 得到的二值图像(参见图2)用作掩模以指示区域,然后应用检测算法.。
图2.(a)初始巴氏涂片图像
(b)二元掩模,它是在预处理步骤之后获得的。
B、候选细胞核质心的检测
在前处理步骤中获得的图像中感兴趣的区域[见图2(b)]包含分离的细胞或细胞簇。 在最后一种情况下,高度的细胞重叠和细胞核强度的不均匀性使得细胞核的检测成为一项艰巨的任务。
我们解决这个问题的方法是基于灰度形态学重建[16]结合图像中区域最小值[17]的检测,它们是连通分量,其强度值相同且小于强度值。 外部边界像素。 这些最小值表示候选细胞核的位置。
一旦我们找到了细胞簇的区域,我们就会计算出包含每个簇的边界框,并在彩色图像中定义相应的子图像。 考虑到细胞核比周围的细胞质更暗,在每个子图像中,我们在彩色图像的红色,绿色和蓝色通道中搜索强度谷。 这些谷由强度值低于特定阈值的像素组成,并且它们由像素限定,其强度值大于该阈值。
为了形成均匀的极小山谷,我们在原始图像中应用了h-minima变换[18]。 以这种方式,如果每个最小值的深度大于或等于给定阈值h,则将最小值视为标记,否则将其消除。 因此,除去较短的峰值,同时保留较高的峰值,即使它们不像以前那样显着
h-最小值变换的应用需要构建标记图像G,其峰值确定原始图像中感兴趣对象的位置。 然后执行来自标记G的原始图像I的形态重建。 为了构建标记图像G,我们从尺寸DI的初始图像的补数I的每个像素中减去阈值h
(3)
根据[16]中的定义,灰度重建是关于灰度图像Gle;I“在”I下的基本测地扩张来定义的。
(4)
其中Goplus;B是扁平结构元素B对G的膨胀,and;代表逐点最小值。 因此,通过迭代n个基本测地扩张来获得尺寸nge;0的灰度测地扩张
(5)
在该等式中,基本测地扩张的输出用作新基本测地扩张的输入,并且这重复n次。 利用上述定义,来自标记G的图像I的灰度重建是通过迭代G“在”I“下的灰度测地扩张直到达到稳定性而获得的。
(6)
用于构造最终图像的算法在[16]中描述。 最终图像是结果图像的补充,它包含区域最小值,其深度小于h,被抑制[见图3(b)]。
图3.(a)具有重叠细胞的细胞簇的初始图像,
(b)产生具有抑制的区域最小值的图像,
(c)区域最小区域,和(d)区域最小区域的质心。
为了确定这些区域最小值,我们在导
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[18791],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、外文翻译、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。