采用模板介导法制备具有不同壁结构的聚多巴胺微胶囊,用于固定化酶
原文作者 Jiafu Shi, Chen Yang, Shaohua Zhang, Xiaoli Wang, Zhongyi Jiang*, Wenyan Zhang, Xiaokai Song, Qinghong Ai, and Chunyong Tian
单位 天津大学化学工程与技术学院,绿色技术教育部重点实验室,300072年天津,中国
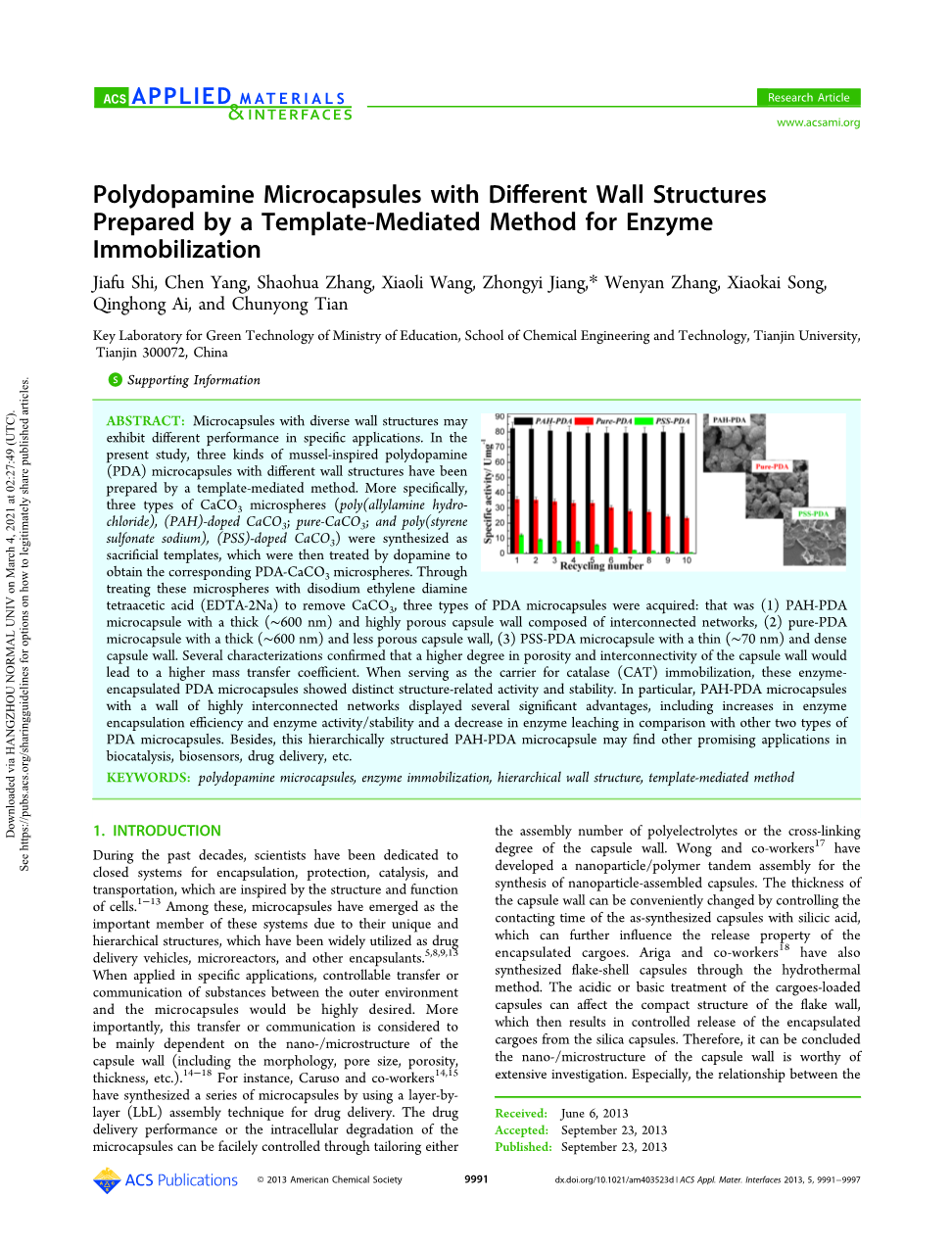
摘要:不同壁结构的微胶囊在特定的应用中表现出不同的性能。本研究采用模板介导的方法制备了三种不同壁结构的贻贝激发聚多巴胺(PDA)微胶囊。分别合成了三种类型的CaCO3微球(聚烯丙胺盐酸盐(PAH)掺杂CaCO3、纯CaCO3、聚苯乙烯磺酸钠(PSS)掺杂CaCO3)作为牺牲模板,通过多巴胺处理得到相应的PDA-CaCO3微球。用乙二胺四乙酸二钠(EDTA-2Na)处理这些微球去除碳酸钙,得到三种类型的PDA微胶囊:(1)具有厚(约600 nm)且囊壁致密的网状结构的PAH-PDA微胶囊,(2)具有厚(约600 nm)且囊壁致密的结构的纯PDA微胶囊,(3)具有薄(约70 nm)且囊壁致密的结构的PSS-PDA微胶囊。几个表征证实,更高的孔隙度和连通度的胶囊壁将导致更高的传质系数。作为过氧化氢酶(CAT)固定化载体,这些酶包被的PDA微胶囊具有明显的结构相关活性和稳定性。特别是,与其他两种PDA微胶囊相比,具有高度互联网络壁的PAH-PDA微胶囊表现出几个显著的优势,包括提高酶包封效率和酶活性或稳定性,降低酶浸出的概率。此外,这种分层结构的多环芳烃- PDA微胶囊在生物催化、生物传感器、药物传递等方面也有广阔的应用前景。
关键词:聚多巴胺微胶囊; 固定化酶; 分层壁结构;模板介导法
1引言
在过去的几十年里,科学家们受到细胞结构和功能的启发,致力于封闭系统的封装、保护、催化和运输。其中,微胶囊因其独特的层次结构而成为这些系统的重要组成部分,被广泛应用于药物传递载体、微反应器等封装材料。当应用于特定应用时,外界环境和微胶囊之间的物质的可控转移或通信将是非常需要的。更重要的是,这种传递或通信被认为主要取决于胶囊壁的纳米/微结构(包括形貌、孔径大小、孔隙率、厚度等)。例如,Caruso和他的同事利用一种分层组装技术合成了一系列用于药物输送的微胶囊。可通过调整聚电解质的组装数量或胶囊壁的交联度,方便地控制微胶囊的药物传递性能或细胞内降解。Wong和他的同事开发了一种纳米粒子/聚合物串联组装体,用于合成纳米粒子组装胶囊。通过控制胶囊与硅酸的接触时间,可以方便地改变胶囊壁的厚度,从而进一步影响胶囊的释放性能。阿里加和他的同事也通过水热法合成了片状壳胶囊。装载货物的胶囊的酸性或碱性处理会影响片状壁的致密结构,从而导致被封装的货物从二氧化硅胶囊中受控释放。因此,胶囊壁的纳米/微结构是值得广泛研究的。特别是胶囊壁的纳米/微结构与应用性能之间的关系,迫切需要为合理设计和合成微胶囊而进行探索。
近年来,海贻贝的生物附着问题引起了人们的广泛关注。多巴胺作为一种小分子仿生胶粘剂,具有以下特点:(1)普遍而强大的粘附力:与几乎所有表面形成强烈的共价和非共价相互作用;(2)温和可控的自聚合:在中性PH附近形成聚多巴胺(PDA)膜、胶囊或其他结构;(3)具有较高的生物相容性和亲水性。用于货物(如药物、酶、DNA等)固定化的PDA微胶囊的制备,而包含不同壁结构的PDA的合成尚未被开发。
本文采用模板介导的酶固定化方法合成了三种不同壁结构的PDA微胶囊。具体来说,首先合成了一系列CaCO3微球(聚苯乙烯磺酸钠(PSS)掺杂CaCO3、纯CaCO3、聚烯丙胺盐酸盐(PAH)掺杂CaCO3)作为牺牲模板,随后经多巴胺处理获得PDA-CaCO3微球。用乙二胺四乙酸(EDTA-2Na)去除碳酸钙,得到了不同壁结构的PDA微胶囊。对合成的PDA微胶囊的物理化学性质进行了详细的表征。以过氧化氢酶(CAT)为模型酶,探讨微胶囊的壁结构与酶的催化活性之间的关系。
2材料与方法
2.1材料
多巴胺购自中国武汉远诚科技发展有限公司。聚4-苯乙烯磺酸钠(PSS, MW ca.70 kDa),聚烯丙胺盐酸盐(PAH, MW ca.70 kDa), 2-氨基-2-(羟甲基)-1,3-丙二醇(三),过氧化氢酶(CAT,过氧化氢氧化还原酶;EC.1.11.1.6)牛肝脏和异硫氰酸荧光素(FITC)从Sigma-Aldrich化工有限公司购买氯化钙(氯化钙),碳酸钠(Na2CO3)、盐酸(HCl),氢氧化钠(氢氧化钠)、乙二胺四乙酸二钠(EDTA-2Na)、磷酸氢二钠(Na2HPO4)和磷酸二氢钠(NaH2PO4)试剂级质量获得Guangfu(天津)。所有其他试剂均为分析级,无需进一步纯化即可使用。整个实验都使用去离子水。使用PHS-3C pH仪(REX Instruments, PHS-3C, Shanghai, China)测量溶液的pH值,并加入100 mM的HCl溶液或100 mM的NaOH溶液进行调节。
2.2不同壁结构聚多巴胺(PDA)微胶囊的制备
以粒径分布窄(约5 mu;m)的PAH掺杂的CaCO3微球为牺牲模板,采用文献中所述的共沉淀法制备。简单地说,将PAH(最终浓度为2 mg/mL)完全溶解于25℃(室温)烧杯中的CaCl2溶液(330 mM)中。然后,在磁搅拌下快速加入等体积的Na2CO3溶液(330 mM),连续搅拌30 s。无搅拌沉淀3分钟后,离心,去离子水洗涤3次。最后得到了粒径约为5 mu;m的球形掺杂碳酸钙颗粒。用50 mM, pH 8.5的tris-HCl缓冲液(50 mM, pH 8.5)洗50 mg的颗粒,多次离心/再分散,然后在浓度为2 mg/mL 盐酸多巴胺的tris-HCl缓冲液(10 mL, 50 mM, pH 8.5)中重新悬浮,可以在在规定的时间内持续摇晃。然后将深褐色颗粒离心(3000g, 2 min),用新鲜的tris-HCl缓冲液冲洗至上清无色,在4°C (15 mM)的EDTA-2Na溶液中去除CaCO3得到PAH-PDA微胶囊。
图1 三种PDA微胶囊(i, PAH-PDA;ii,pure-PDA;ii, PSS-PDA微胶囊)具有不同的壁结构
纯PDA和PSS-PDA微胶囊的合成过程和条件与PAH-PDA微胶囊相似。唯一的区别在于以下几个方面。对于纯PDA微胶囊,在合成纯碳酸钙微球过程中不使用添加剂。对于PSS- PDA微胶囊,在合成PAH- CaCO3微球时使用PSS代替PAH,微球的沉淀时间固定为30分钟,而不是3分钟。
2.3传质特性
在本体溶液以及三种PDA微胶囊中的过氧化氢的传质特性的是根据前面的调查报告得出的。60mu;L集中微胶囊的解决方案是沉浸在10毫升的搅拌好的pH值7.0,30mM 的tris-HCl缓冲溶液,并且含有19.4毫米过氧化氢的解决方案,所有测量均在25°C下进行。在设计的时间间隔内,用日立U-3010紫外/可见分光光度计(UV/vis分光光度计)作为检测器测定体液中的H2O2浓度。溶液中H2O2的含量表示为式(1)(1)式中C0和Ct分别为0时刻和t时刻本体溶液中H2O2浓度(M)。
根据以往的报道,溶液中H2O2的含量可由式(2)描述(2)式中Dm为微胶囊的传质系数(m2 /s); R为微胶囊的半径(m);alpha;定义为(V/N)(4pi;R3/3), V为不含微胶囊所占空间的溶液体积(L);而qn为上述方程的eq 3(3)的非零正根,则可以得到Dm。
2.4表征
采用场发射扫描电镜(FESEM, Nanosem 430)记录了三种微胶囊的扫描电镜图像。在JEM-100CX II型仪器上进行透射电镜(TEM)观察。在Nicolet-6700光谱仪上获得了傅立叶变换红外(FTIR)光谱。累计扫描32次,每个光谱的分辨率为4 cm-1。光学图像使用奥林巴斯BX51显微镜和100 times;油浸物镜(奥林巴斯,东京,日本)。用LSM 710共聚焦显微镜拍摄激光共聚焦扫描显微镜(CLSM)图像。根据FITC标记的酶,选择激发波长为488 nm。
2.5固定化酶的实验
2.5.1固定化酶
一定量的CAT溶解于1ml的Tris-HCl缓冲溶液(50mM, pH 7.0)中。酶液加入到4ml的330 mM CaCl2溶液中。密封的CAT PDA微胶囊的制备步骤与上述步骤相同(第2.2节)。
2.5.2酶活性
直接测定H2O2在240 nm处因酶解引起的吸光度下降,从而确定固定化或游离CAT的活性。简单地说,30 mu;L的固定化酶(或游离酶)(约0.0463 mg酶)分散在19.4 mM H2O2中,10 mL PBS (50 mM, pH 7.0), 25℃,5 min后记录240 nm吸光度的下降,并计算活性。1单位(U)的CAT在pH 7.0和25℃下每分钟分解1 mu;mol H2O2。
2.5.3回收与贮存稳定性
经过多次循环使用后,通过在25℃下测量CAT的残余比活度来确定包覆CAT的循环稳定性。每个反应批次(25℃,pH 7.0,反应时间60 min)后,离心收集CAT包封的PDA微胶囊,用PBS彻底冲洗干净,下一个反应周期重复使用。在所有的稳定性实验中,每个结果都是通过三个单独实验的平均得到的。
包封的CAT以凝胶状态4℃保存一段时间后,通过测定CAT在25℃下的残余比活性来确定其贮藏稳定性。
2.5.4动力学参数(Km和Vmax)
固定化酶和游离酶的Km和Vmax的测定采用Michaelis-Menten模型,由eq 4给出(4)其中V为初始反应速率(mM min-1);[S]为初始底物浓度(mM), Vmax为无限初始底物浓度下的最大反应速率(mM min-1);Km为Michaelis-Menten常数(mM)。测定Km和Vmax,在3 ~ 35 mM的不同H2O2浓度下进行活性测定。在25℃下,用PBS (50 mM, pH 7.0)测定酶活性。相应计算了自由和固定酶的动力学参数。
3结果与讨论
3.1不同壁结构PDA微胶囊的合成与表征
3.1.1 PAH-PDA微胶囊
先前的报道已经证明,在
剩余内容已隐藏,支付完成后下载完整资料
采用模板介导法制备具有不同壁结构的聚多巴胺微胶囊,用于固定化酶
原文作者 Jiafu Shi, Chen Yang, Shaohua Zhang, Xiaoli Wang, Zhongyi Jiang*, Wenyan Zhang, Xiaokai Song, Qinghong Ai, and Chunyong Tian
单位 天津大学化学工程与技术学院,绿色技术教育部重点实验室,300072年天津,中国
摘要:不同壁结构的微胶囊在特定的应用中表现出不同的性能。本研究采用模板介导的方法制备了三种不同壁结构的贻贝激发聚多巴胺(PDA)微胶囊。分别合成了三种类型的CaCO3微球(聚烯丙胺盐酸盐(PAH)掺杂CaCO3、纯CaCO3、聚苯乙烯磺酸钠(PSS)掺杂CaCO3)作为牺牲模板,通过多巴胺处理得到相应的PDA-CaCO3微球。用乙二胺四乙酸二钠(EDTA-2Na)处理这些微球去除碳酸钙,得到三种类型的PDA微胶囊:(1)具有厚(约600 nm)且囊壁致密的网状结构的PAH-PDA微胶囊,(2)具有厚(约600 nm)且囊壁致密的结构的纯PDA微胶囊,(3)具有薄(约70 nm)且囊壁致密的结构的PSS-PDA微胶囊。几个表征证实,更高的孔隙度和连通度的胶囊壁将导致更高的传质系数。作为过氧化氢酶(CAT)固定化载体,这些酶包被的PDA微胶囊具有明显的结构相关活性和稳定性。特别是,与其他两种PDA微胶囊相比,具有高度互联网络壁的PAH-PDA微胶囊表现出几个显著的优势,包括提高酶包封效率和酶活性或稳定性,降低酶浸出的概率。此外,这种分层结构的多环芳烃- PDA微胶囊在生物催化、生物传感器、药物传递等方面也有广阔的应用前景。
关键词:聚多巴胺微胶囊; 固定化酶; 分层壁结构;模板介导法
1引言
在过去的几十年里,科学家们受到细胞结构和功能的启发,致力于封闭系统的封装、保护、催化和运输。其中,微胶囊因其独特的层次结构而成为这些系统的重要组成部分,被广泛应用于药物传递载体、微反应器等封装材料。当应用于特定应用时,外界环境和微胶囊之间的物质的可控转移或通信将是非常需要的。更重要的是,这种传递或通信被认为主要取决于胶囊壁的纳米/微结构(包括形貌、孔径大小、孔隙率、厚度等)。例如,Caruso和他的同事利用一种分层组装技术合成了一系列用于药物输送的微胶囊。可通过调整聚电解质的组装数量或胶囊壁的交联度,方便地控制微胶囊的药物传递性能或细胞内降解。Wong和他的同事开发了一种纳米粒子/聚合物串联组装体,用于合成纳米粒子组装胶囊。通过控制胶囊与硅酸的接触时间,可以方便地改变胶囊壁的厚度,从而进一步影响胶囊的释放性能。阿里加和他的同事也通过水热法合成了片状壳胶囊。装载货物的胶囊的酸性或碱性处理会影响片状壁的致密结构,从而导致被封装的货物从二氧化硅胶囊中受控释放。因此,胶囊壁的纳米/微结构是值得广泛研究的。特别是胶囊壁的纳米/微结构与应用性能之间的关系,迫切需要为合理设计和合成微胶囊而进行探索。
近年来,海贻贝的生物附着问题引起了人们的广泛关注。多巴胺作为一种小分子仿生胶粘剂,具有以下特点:(1)普遍而强大的粘附力:与几乎所有表面形成强烈的共价和非共价相互作用;(2)温和可控的自聚合:在中性PH附近形成聚多巴胺(PDA)膜、胶囊或其他结构;(3)具有较高的生物相容性和亲水性。用于货物(如药物、酶、DNA等)固定化的PDA微胶囊的制备,而包含不同壁结构的PDA的合成尚未被开发。
本文采用模板介导的酶固定化方法合成了三种不同壁结构的PDA微胶囊。具体来说,首先合成了一系列CaCO3微球(聚苯乙烯磺酸钠(PSS)掺杂CaCO3、纯CaCO3、聚烯丙胺盐酸盐(PAH)掺杂CaCO3)作为牺牲模板,随后经多巴胺处理获得PDA-CaCO3微球。用乙二胺四乙酸(EDTA-2Na)去除碳酸钙,得到了不同壁结构的PDA微胶囊。对合成的PDA微胶囊的物理化学性质进行了详细的表征。以过氧化氢酶(CAT)为模型酶,探讨微胶囊的壁结构与酶的催化活性之间的关系。
2材料与方法
2.1材料
多巴胺购自中国武汉远诚科技发展有限公司。聚4-苯乙烯磺酸钠(PSS, MW ca.70 kDa),聚烯丙胺盐酸盐(PAH, MW ca.70 kDa), 2-氨基-2-(羟甲基)-1,3-丙二醇(三),过氧化氢酶(CAT,过氧化氢氧化还原酶;EC.1.11.1.6)牛肝脏和异硫氰酸荧光素(FITC)从Sigma-Aldrich化工有限公司购买氯化钙(氯化钙),碳酸钠(Na2CO3)、盐酸(HCl),氢氧化钠(氢氧化钠)、乙二胺四乙酸二钠(EDTA-2Na)、磷酸氢二钠(Na2HPO4)和磷酸二氢钠(NaH2PO4)试剂级质量获得Guangfu(天津)。所有其他试剂均为分析级,无需进一步纯化即可使用。整个实验都使用去离子水。使用PHS-3C pH仪(REX Instruments, PHS-3C, Shanghai, China)测量溶液的pH值,并加入100 mM的HCl溶液或100 mM的NaOH溶液进行调节。
2.2不同壁结构聚多巴胺(PDA)微胶囊的制备
以粒径分布窄(约5 mu;m)的PAH掺杂的CaCO3微球为牺牲模板,采用文献中所述的共沉淀法制备。简单地说,将PAH(最终浓度为2 mg/mL)完全溶解于25℃(室温)烧杯中的CaCl2溶液(330 mM)中。然后,在磁搅拌下快速加入等体积的Na2CO3溶液(330 mM),连续搅拌30 s。无搅拌沉淀3分钟后,离心,去离子水洗涤3次。最后得到了粒径约为5 mu;m的球形掺杂碳酸钙颗粒。用50 mM, pH 8.5的tris-HCl缓冲液(50 mM, pH 8.5)洗50 mg的颗粒,多次离心/再分散,然后在浓度为2 mg/mL 盐酸多巴胺的tris-HCl缓冲液(10 mL, 50 mM, pH 8.5)中重新悬浮,可以在在规定的时间内持续摇晃。然后将深褐色颗粒离心(3000g, 2 min),用新鲜的tris-HCl缓冲液冲洗至上清无色,在4°C (15 mM)的EDTA-2Na溶液中去除CaCO3得到PAH-PDA微胶囊。
图1 三种PDA微胶囊(i, PAH-PDA;ii,pure-PDA;ii, PSS-PDA微胶囊)具有不同的壁结构
纯PDA和PSS-PDA微胶囊的合成过程和条件与PAH-PDA微胶囊相似。唯一的区别在于以下几个方面。对于纯PDA微胶囊,在合成纯碳酸钙微球过程中不使用添加剂。对于PSS- PDA微胶囊,在合成PAH- CaCO3微球时使用PSS代替PAH,微球的沉淀时间固定为30分钟,而不是3分钟。
2.3传质特性
在本体溶液以及三种PDA微胶囊中的过氧化氢的传质特性的是根据前面的调查报告得出的。60mu;L集中微胶囊的解决方案是沉浸在10毫升的搅拌好的pH值7.0,30mM 的tris-HCl缓冲溶液,并且含有19.4毫米过氧化氢的解决方案,所有测量均在25°C下进行。在设计的时间间隔内,用日立U-3010紫外/可见分光光度计(UV/vis分光光度计)作为检测器测定体液中的H2O2浓度。溶液中H2O2的含量表示为式(1)(1)式中C0和Ct分别为0时刻和t时刻本体溶液中H2O2浓度(M)。
根据以往的报道,溶液中H2O2的含量可由式(2)描述(2)式中Dm为微胶囊的传质系数(m2 /s); R为微胶囊的半径(m);alpha;定义为(V/N)(4pi;R3/3), V为不含微胶囊所占空间的溶液体积(L);而qn为上述方程的eq 3(3)的非零正根,则可以得到Dm。
2.4表征
采用场发射扫描电镜(FESEM, Nanosem 430)记录了三种微胶囊的扫描电镜图像。在JEM-100CX II型仪器上进行透射电镜(TEM)观察。在Nicolet-6700光谱仪上获得了傅立叶变换红外(FTIR)光谱。累计扫描32次,每个光谱的分辨率为4 cm-1。光学图像使用奥林巴斯BX51显微镜和100 times;油浸物镜(奥林巴斯,东京,日本)。用LSM 710共聚焦显微镜拍摄激光共聚焦扫描显微镜(CLSM)图像。根据FITC标记的酶,选择激发波长为488 nm。
2.5固定化酶的实验
2.5.1固定化酶
一定量的CAT溶解于1ml的Tris-HCl缓冲溶液(50mM, pH 7.0)中。酶液加入到4ml的330 mM CaCl2溶液中。密封的CAT PDA微胶囊的制备步骤与上述步骤相同(第2.2节)。
2.5.2酶活性
直接测定H2O2在240 nm处因酶解引起的吸光度下降,从而确定固定化或游离CAT的活性。简单地说,30 mu;L的固定化酶(或游离酶)(约0.0463 mg酶)分散在19.4 mM H2O2中,10 mL PBS (50 mM, pH 7.0), 25℃,5 min后记录240 nm吸光度的下降,并计算活性。1单位(U)的CAT在pH 7.0和25℃下每分钟分解1 mu;mol H2O2。
2.5.3回收与贮存稳定性
经过多次循环使用后,通过在25℃下测量CAT的残余比活度来确定包覆CAT的循环稳定性。每个反应批次(25℃,pH 7.0,反应时间60 min)后,离心收集CAT包封的PDA微胶囊,用PBS彻底冲洗干净,下一个反应周期重复使用。在所有的稳定性实验中,每个结果都是通过三个单独实验的平均得到的。
包封的CAT以凝胶状态4℃保存一段时间后,通过测定CAT在25℃下的残余比活性来确定其贮藏稳定性。
2.5.4动力学参数(Km和Vmax)
固定化酶和游离酶的Km和Vmax的测定采用Michaelis-Menten模型,由eq 4给出(4)其中V为初始反应速率(mM min-1);[S]为初始底物浓度(mM), Vmax为无限初始底物浓度下的最大反应速率(mM min-1);Km为Michaelis-Menten常数(mM)。测定Km和Vmax,在3 ~ 35 mM的不同H2O2浓度下进行活性测定。在25℃下,用PBS (50 mM, pH 7.0)测定酶活性。相应计算了自由和固定酶的动力学参数。
3结果与讨论
3.1不同壁结构PDA微胶囊的合成与表征
3.1.1 PAH-PDA微胶囊
先前的报道已经证明,在
剩余内容已隐藏,支付完成后下载完整资料
英语原文共 7 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[271222],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、外文翻译、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 聚苯胺的制备及其在超级电容器方面的应用文献综述
- 亚苯基主链萨伦铬的制备及催化二氧化碳共聚合的研究文献综述
- 镧合并ß-Ni(OH)2纳米阵列用于稳健的尿素电氧化外文翻译资料
- 基于Lewis碱性吡啶的金属有机荧光探针外文翻译资料
- 软配体在纳米粒子超晶格组装中的作用外文翻译资料
- Janus膜具有可控的不对称配置,用于高效的油乳液分离外文翻译资料
- 具有 Janus 表面的中空纤维膜用于水包油乳液的连续破乳和分离 ——副标题外文翻译资料
- 具有芴基卡多结构的聚苯硫醚具有高透明度、高折射率和低双折射外文翻译资料
- 聚碳酸酯聚合物中芴的聚合度与光热性能的关系外文翻译资料
- 通过狭窄的纳米孔与孤立圆孔连接的阶级多孔膜:一种新颖的在分离中解决权衡效应的解决方案外文翻译资料