英语原文共 3 页,剩余内容已隐藏,支付完成后下载完整资料
镁分子内激态质子转移的比例荧光探针
Narinder Singh , Navneet Kaur , Ray C. Mulrooney , John F. Callan,
摘要
研制了一种简单的用于pH=7的半水溶液中镁离子定量识别荧光传感器。该传感器是Schiff碱,通过激发态分子内质子转移(ESIPT)产生一个具有良好的镁离子结合能力的酮互变异构体。该传感器比其他金属离子(包括碱/碱土离子)显示出良好的选择性,可测量2.0到30.0um之间的Mg2 离子浓度。根据化学计量学建立为2:1(主体:客体),结合常数(K21)为(1.4 plusmn; 0.1)*104M。该传感器可用于检测高镁血症等疾病。
正文
镁是细胞内第二丰富的阳离子和体内第四丰富的阳离子。1在磷酸转移反应中作为辅酶发挥重要作用,在DNA合成中作为辅助因子,有助于调节信号转导。2硫酸镁目前用于治疗许多疾病,包括心律失常、心肌梗死和子痫。3它也正用于血管痉挛的康复治疗,这种并发症在蛛网膜下腔出血(SAH)患者中很常见,并可导致因脑缺血和梗塞而死亡。4每年在英国发生的11万例中风中,约5%是由蛛网膜下腔出血引起的。然而使用硫酸镁治疗血管痉挛导致的高镁血症可能是医源性的。5在极端情况下,高镁血症可导致心脏骤停,因此,简单、快速的检测方法具有明显的益处。
镁的有效检测需要一种灵敏度高、对镁离子选择性高于钙离子的方法,以及在水或半水介质中操作的能力。6荧光光谱因其灵敏度高、响应速度快、成本相对较低而在分子传感中继续发挥着重要作用。然而,大多数报告的镁离子荧光探针是非比例测量的,即,它们使用单波长工作。7由于该方法不存在与受体浓度、光漂白和环境影响有关的误差,因此比传统的单波长荧光识别具有优势。8已经报道了用于开发比率荧光传感器的各种策略。9传感器1b中的激发态分子内质子转移(ESIPT)过程可以提供双通道发射10以及酮互变异构体(2b)作为Mg 2 的有效受体(参见方案1)。7a–d
计划1 反应和条件:(i)干燥MeOH, 30分钟(i i);NaBH4, THF/MeOH, 5 h。
按照已知方法,分别使2-氨基苯硫酚和苯胺与2-羟基-1-萘甲醛在甲醇中反应,合成传感器1b和对照化合物1a。11通过THF/ MeOH溶剂系统中使用NaBH4还原1b来制备对照化合物3(参见补充数据)。
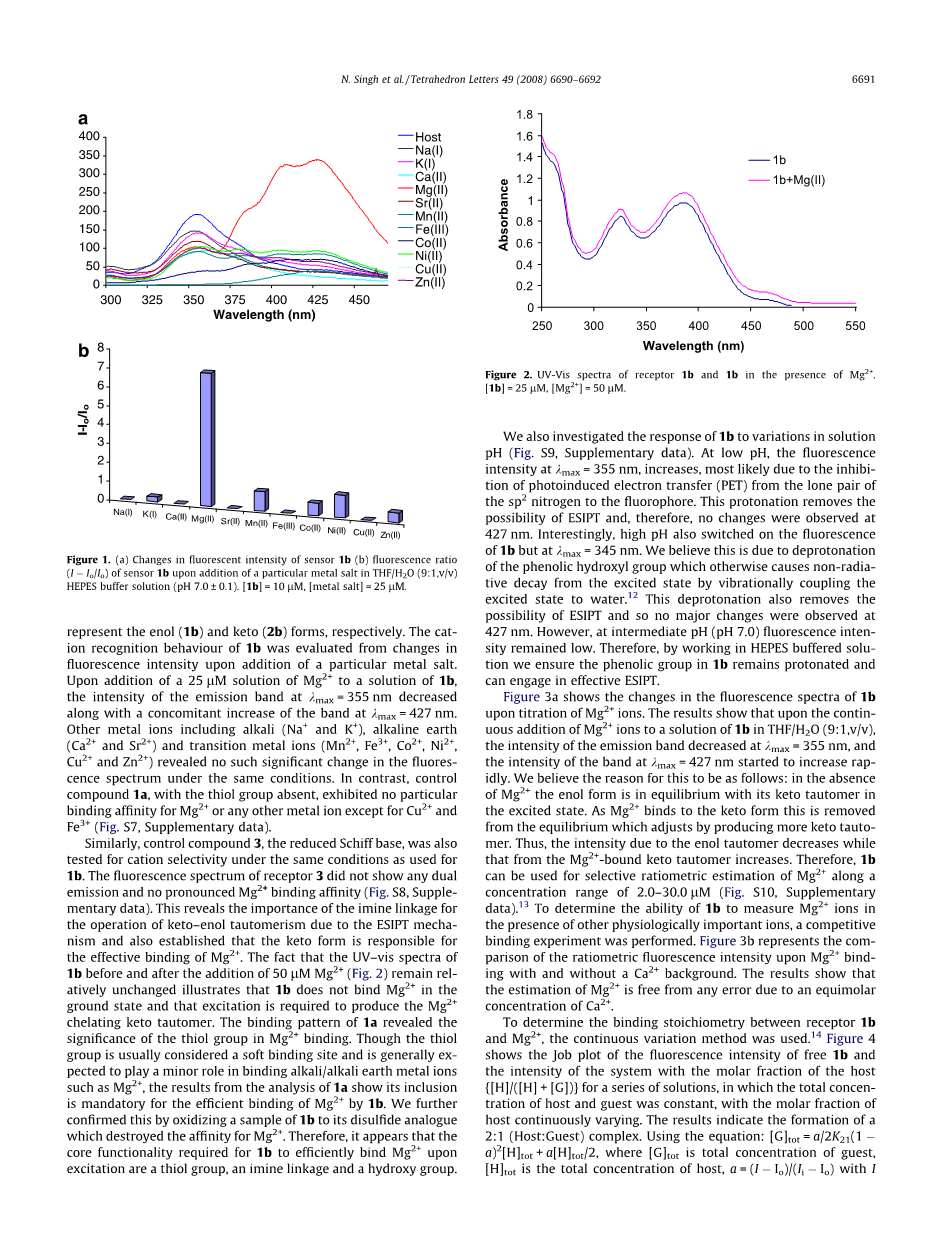
在THF / H2O(9:1,v / v)溶剂体系中的10mu;M1b溶液显示出在275nm激发时在kmax=355和427nm处具有双发射的荧光光谱(图1a)。这两个波段分别代表烯醇(1b)和酮(2b)的形式。通过添加特定金属盐时荧光强度的变化评估1b的阳离子识别行为。在向1b的溶液中加入25mu;M的Mg2 溶液时,在kmax=355nm处的发射带的强度随着在kmax=427nm处的带的伴随增加而降低。其他金属离子包括碱(Na 和K ),碱土(Ca2 和Sr2 )和过渡金属离子(Mn2 ,Fe3 ,Co2 ,Ni2 ,Cu2 和Zn2 )显示在相同条件下,荧光光谱没有这种显著变化。相反,没有硫醇基团的对照化合物1a对Mg2 或除Cu2 和Fe3 之外的任何其它金属离子没有表现出特别的结合亲和力(图S7,补充数据)。
图1 (a)传感器中1b荧光强度的变化(b)传感器1b在THF/ H2O (9:1,v/v)HEPES缓冲液(pH 7.0plusmn;0.1)中加入特定金属盐后的荧光比。(I-Io/Io) [1b] = 10uM, [金属盐] = 25uM.
类似地,还在与1b所用相同的条件下测试对照化合物3(还原的席夫碱)的阳离子选择性。受体3的荧光光谱未显示任何双重发射并且没有明显的Mg2 结合亲和力(图S8,补充数据)。这揭示了由于ESIPT机制,亚胺连接对于酮-烯醇互变异构体的操作的重要性,并且还确定了酮形式负责Mg2 的有效结合。加入50mu;M Mg2 之前和之后1b的紫外-可见光谱(图2)保持相对不变,说明1b在基态中不结合Mg2 并且需要激发产生Mg2 螯合酮互变异构体。1a的结合模式揭示了硫醇基团在Mg2 结合中的重要性。硫醇基通常被认为是一个软结合位点,一般被认为在与Mg2 等碱土金属离子的结合中起较小的作用,对1a进行分析的结果表明,它的包含是Mg2 与1b有效结合的必由之路。1b样品氧化为二硫化类似物,破坏了Mg2 的亲和力,进一步证实了这一点。因此, 1b在激发时有效结合Mg 2 所需的核心官能团是硫醇基团,亚胺键和羟基。
图2 在Mg2 存在下受体1b和1b的紫外-可见光谱[1b] = 10uM, [Mg2 ] = 25uM
我们还研究了1b对溶液pH变化的响应(图S9,补充数据)。在低pH下,kmax=355nm处的荧光强度增加,这很可能是由于sp2氮的孤对对光诱导电子转移(PET)被抑制所致。这种质子化消除了ESIPT的可能性,因此,在427nm处没有观察到任何变化。有趣的是,高pH值也会激活1b的荧光,但在kmax=345nm处。我们认为这是由于酚羟基的去质子化,否则会通过激发态与水的振动耦合导致激发态的非辐射衰变。12这种去质子化也消除了ESIPT的可能性,因此在427nm处没有观察到大的变化。然而,在中等pH值(pH 7.0)时,荧光强度仍然较低。因此,通过在HEPES缓冲液中工作,我们确保1b中的酚基保持质子化,并能进行有效的ESIPT。
图3a显示了Mg2 离子滴定后1b荧光光谱的变化。结果表明,在THF/H2O溶液中(9:1,v/v), Mg2 离子连续加入1b溶液后,kmax=355nm处发射带强度减小,kmax=427nm处发射带强度开始迅速增大。其原因如下:在没有Mg2 的情况下,烯醇的形式与其酮互变异构物处于激发态平衡。当Mg2 与酮结合时,这种平衡被打破,而反应向产生更多酮互变异构物进行。因此,烯醇互变异构引起的强度降低,而Mg2 结合酮互变异构引起的强度增加。因此1b可用于Mg2 在2.0 ~ 30.0uM浓度范围内的选择性比值估计(图S10,补充数据)。13为了确定1b在其他重要生理离子存在时测量Mg2 离子的能力,进行了竞争性结合实验。图3b为Mg2 有无与Ca2 结合时的比值荧光强度对比图。结果表明,在等摩尔浓度的钙离子作用下,Mg2 的估算没有任何误差。
采用连续变异法测定受体1b与Mg2 的结合化学计量学。14图4显示了工作的游离的1 b的荧光强度和系统的强度与主体的摩尔分数{[H] / [H] [G])}的一系列解决方案,在主体和客体的总浓度是常数,与主体的摩尔分数不断变化。结果表明,形成了一种2:1(主客比)复合体。使用方程[G]tot=alpha;/2K21(1-alpha;)2[H]tot alpha;[H]tot,/2,[G]tot是客体总浓度, [H]tot是主体的总浓度, alpha;=(I-I0)I是在特定Mg2 浓度,Ii是无限Mg2 的浓度下的荧光强度,结合常数K21分别是1.4*104plusmn;0.1 M-2。15这一数值低于非线性曲线拟合的预期,可以解释为:Mg2 结合导致两个先前在溶液中游离的受体结合,不利于熵增反应的发生。16此外,Mg2 必须与酮烯醇互变异构过程竞争,才能与酮形成络合物。这些相互矛盾的过程可能导致缔合常数低于预期。
综上所述,我们开发了一种新型荧光传感器用于Mg2 的比色法测定。由ESIPT形成酮互变异构体对Mg2 识别至关重要,并提供了双发射,使比率测定成为可能。据我们所知,这是第一个报道的使用ESIPT的镁比率测量探头的例子。该探针不受钙离子的干扰,可为高镁血症提供一种简便、快速的检测方法。
致谢
作者感谢EPSRC和RGU提供的财政援助。他们也要感谢位于斯旺西的EPSRC国家质谱服务中心提供的准确的质量数据。
补充数据
与本文相关的补充数据(包括实验细节、光谱和图表)可在网上找到,doi:10.1016/j.tetlet.2008.09.052.
参考资料
1. Hans, C. P.; Sialy, R.; Bansal, D. D. Curr. Sci. 2002, 83, 1456–1463.
2. (a) Orsquo;Rourke, B.; Backx, P. H.; Marban, E. Science 1992, 257, 245–248; (b) Politi,
H. C.; Preston, R. R. Neuroreport 2003, 14, 659–668; (c) Dai, L.-J.; Ritchie, G.;
Kerstan, D.; Kang, H. S.; Cole, D. E. C.; Quamme, G. A. Physiol. Rev. 2001, 81, 51–
84; (d) Schmitz, C.; Perraud, A.; Johnson, C. O.; Inabe, K.; Smith, M. K.; Penner,
R.; Kurosaki, T.; Fleig, A.; Scharenberg, A. M. Cell 2003, 113, 191–200; (e)
Flatman, P. W. Annu. Rev. Physiol. 1991, 53, 259–271.
3. British National Formulary; The Pharmaceutical Press, 2004; p 463.
4. (a) Chia, R. Y.; Hughes, R. S.; Morgan, M. K. J. Clin. Neuroscience 2002, 9, 279–
281; (b) Yahia, A. M.; Kirmani, J. F.; Qureshi, A. I.; Guterman, L. R.; Hopkin, L. N.
Neurocrit. Care 2005, 3, 16–23.
5. Bradford, C.; McElduff, A. Crit. Care Resuscitation 2006, 8, 36–39.
6. (a) Brocard, J. B.; Rajdev, S.; Reynolds, I. J. Neuron 1993, 11, 751–757; (b) Cheng,
C.; Reynolds, I. J. Neuroscience 2000, 95, 973–979; (c) Gotoh, H.; Kajikawa, M.;
Kato, H.; Suto, K. Brain Res. 1999, 828, 163–168.
7. (a) Ray, D.; Bharadwaj, P. K. Inorg. Chem. 2008, 47, 2252–2254; (b) Kim, H. M.;
Yang, P. R.; Seo, M. S.; Yi, J.-S.; Hong, J. H.; Jeon, S.-J.; Ko, Y.-G.; Lee, K. J.; Cho, B.
R. J. Org. Chem. 2007, 72, 2088–2096; (c) Komatsu, H.; Iwasawa, N.; Citterio, D.;
Suzuki, Y.; Kubota, T.; Tokuno, K.; Kitamura, Y.; Oka, K.; Suzuki, K. J. Am. Chem.
Soc. 2004, 126, 16353–16360; (d) Suzuki, Y.; Komatsu, H.; Ikeda, T.; Saito, N.;
Araki, S.; Citterio, D.; Hisamoto, H.; Kitamura, Y.; Kubota, T.; Nakagawa, J.; Oka,
K.; Suzuki, K. Anal. Chem. 2002, 74, 1423–1428; (e) Park, E. J.; Brasuel, M.;
Behrend, C.; Philbert, M. A.; Kopelman, R. Anal. Chem. 2003, 75, 3784–3791; (f)
Farruggia, G.; Iotti, S.; Prodi, L.; Montalti, M.; Zaccheroni, N.; Savage, P . B.;
Trapani, V.; Sale, P.; Wolf, F. I. J. Am. Chem. Soc. 2006, 128, 344; (g) de Silva, A. P.; 剩余内容已隐藏,支付完成后下载完整资料
资料编号:[19220],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、外文翻译、任务书、文献综述、开题报告、程序设计、图纸设计等资料可联系客服协助查找。